ТИВДАК&#к00АЕ; Одобрено од стране ФДА: Циљање на ткивни фактор код рака грлића материце
Последње прегледано: 14.06.2024

Сви иЛиве садржаји су медицински прегледани или проверени како би се осигурала што већа тачност.
Имамо стриктне смјернице за набавку и само линкамо на угледне медијске странице, академске истраживачке институције и, кад год је то могуће, медицински прегледане студије. Имајте на уму да су бројеви у заградама ([1], [2], итд.) Везе које се могу кликнути на ове студије.
Ако сматрате да је било који од наших садржаја нетачан, застарио или на неки други начин упитан, одаберите га и притисните Цтрл + Ентер.
29. Априла 2024. Године, Америчка управа за храну и лекове (ФДА) је у потпуности одобрила ТИВДАКк00АЕ; (тисотумаб ведотин) компаније Сеаген Инц., који циља ткивни фактор (ТФ) за лечење пацијената са рекурентним или метастатским раком грлића материце који су напредовали током или после хемотерапија. Ово представља значајан напредак у терапији рака грлића материце, наглашавајући потенцијал коњугата антитело-лек (АДЦ) у онкологији.
Механизам деловања ТИВДАК-а
Тивдак је АДЦ лек који циља на ТФ, комбинујући Генмаб-ово анти-ТФ моноклонско антитело тисотумаб са Сеаген-овом АДЦ технологијом дизајнираном да циља ТФ антигене на ћелије рака и испоручи цитотоксични део ММАЕ директно у ћелије рака.
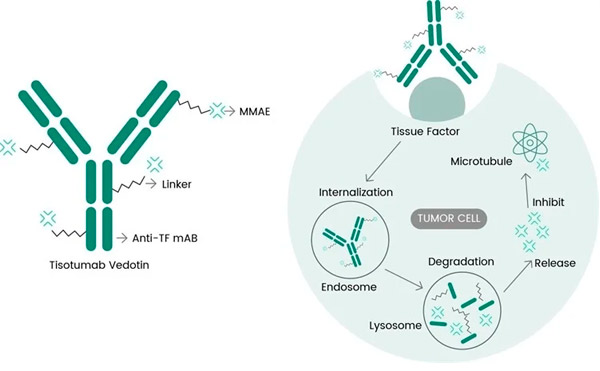
Молекуларниј механизм дејствиа тисотумаба ведотина (хттпс://дои.орг/10.3390/ијмс23073559а>)
ТФ: идеальнаа мишень дла разработки АДЦ
Известно, что ТФ уествует в сигнальних путах опухолевого роста и ангиогенезе и прекомерно експрессируетса у подавлаусего большинства пациентов с раком шејки матки и многих других тврдих опухола. Его способност брзо интернализоватьса при свазании с антителами и минимальное утицај на нормальние процеси свертиваниа крови додатно повишаут его погодность дла целинаправленној терапиа рака.
