Научници су открили нови имуносупресивни механизам код рака мозга
Последње прегледано: 14.06.2024

Сви иЛиве садржаји су медицински прегледани или проверени како би се осигурала што већа тачност.
Имамо стриктне смјернице за набавку и само линкамо на угледне медијске странице, академске истраживачке институције и, кад год је то могуће, медицински прегледане студије. Имајте на уму да су бројеви у заградама ([1], [2], итд.) Везе које се могу кликнути на ове студије.
Ако сматрате да је било који од наших садржаја нетачан, застарио или на неки други начин упитан, одаберите га и притисните Цтрл + Ентер.
Ванредни професор др Филипо Веља и његов тим на Вистар институту открили су кључни механизам помоћу којег глиобластом—озбиљан и често фаталан рак мозга — потискује имуни систем тако да тумор може да расте а да не наиђе на отпор одбрамбених механизама тела.
Њихово откриће је објављено у чланку „Лактилација хистона вођена глукозом промовише имуносупресивну активност макрофага добијених из моноцита у глиобластому“ у Иммунити.
„Наше истраживање показује да се механизми самоочувања рака, ако су довољно схваћени, могу веома ефикасно користити против болести“, рекао је др Веља.
„Радујем се будућим истраживањима механизама метаболичке имуносупресије код глиобластома и надам се да ћемо наставити да учимо више о томе како боље разумети и борити се против овог рака.“
До сада је мало проучавано о томе како макрофаги и микроглија изведени из моноцита стварају имуносупресивно туморско микроокружење у глиобластому.
Веглиа лабораторија је истраживала ћелијске механизме имуносупресије код глиобластома и открила да како глиобластом напредује, макрофаги изведени из моноцита почињу да надмашују микроглију, што указује на то да је преовлађивање макрофага изведених из моноцита у туморском микроокружењу за рак. Избегавајући имуни одговор.
Заиста, макрофаги изведени из моноцита, али не и микроглија, блокирали су активност Т ћелија (имуних ћелија које уништавају ћелије тумора) у претклиничким моделима и код пацијената. Тим је ово потврдио проценом претклиничких модела глиобластома са вештачки смањеним бројем макрофага добијених из моноцита.
Као што се и очекивало, модели са мање малигних макрофага у микроокружењу тумора показали су побољшане резултате у поређењу са стандардним моделима глиобластома.
Глиобластом чини нешто више од половине свих малигних тумора који настају у мозгу, а прогноза за пацијенте са дијагнозом ове болести је изузетно лоша: само 25% пацијената преживи прву годину након дијагнозе. Глиобластом је опасан не само због своје локације у мозгу, већ и због имуносупресивног туморског микроокружења, које чини глиобластом отпорним на обећавајуће имунотерапије.
Програмирањем одређених имуних ћелија, као што су макрофаги (макрофаги и микроглија изведени из моноцита), да раде за тумор, а не против њега, глиобластом ствара туморско микроокружење за себе које омогућава раку да расте агресивно док избегава анти-канцер имуни одговори.
Проналажење механизма
Пошто је потврдила улогу макрофага добијених из моноцита, Веглиа-ина лабораторија је затим покушала да разуме како тачно ове имуне ћелије повезане са раком делују против имуног система.
Секвенционисали су макрофаге да би утврдили да ли ћелије имају било какве абнормалне обрасце експресије гена који би могли указивати на гене који играју улогу у имуносупресији, а такође су испитали метаболичке обрасце макрофага да би разумели да ли је абнормална експресија гена повезана са метаболизмом.
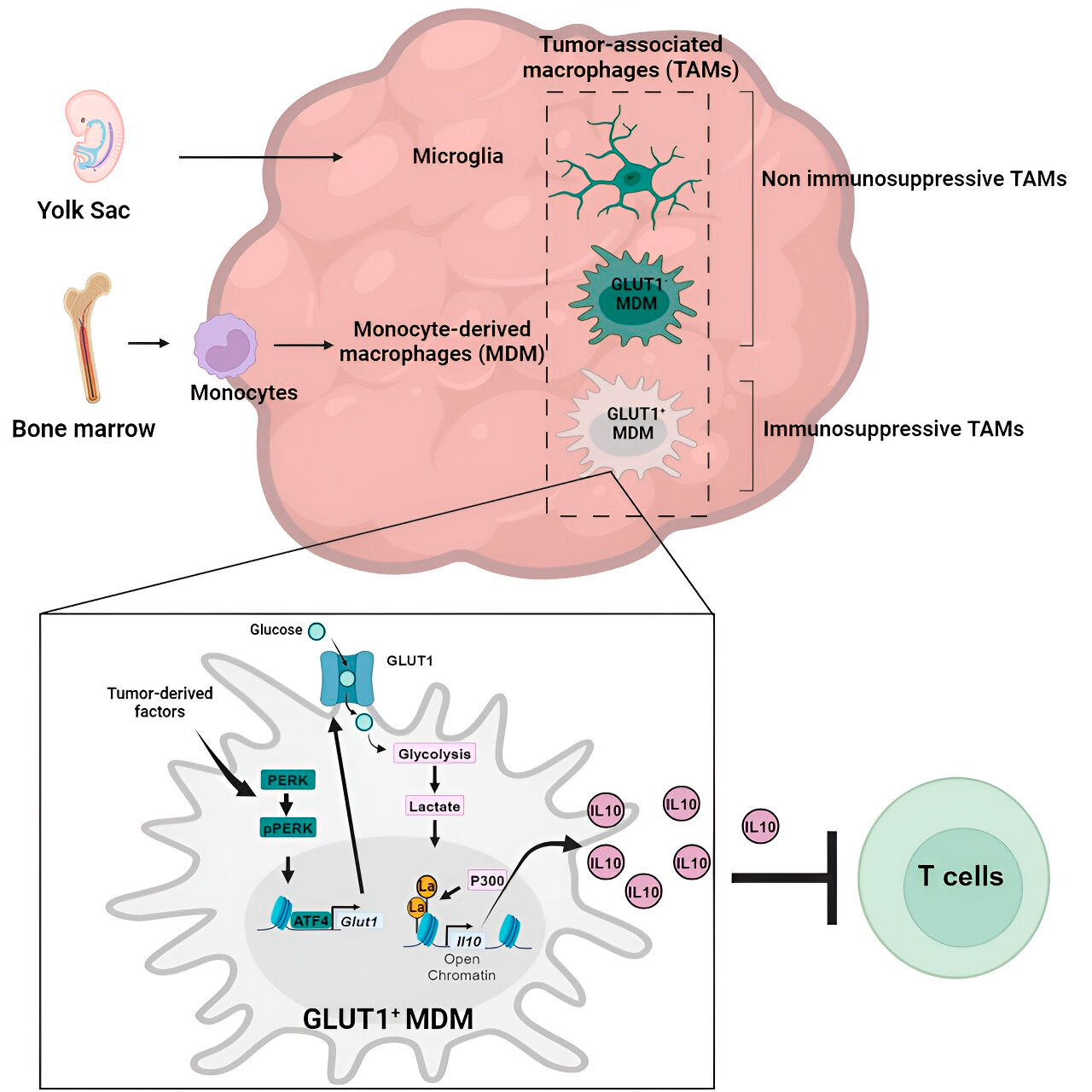
>Анализа гена и метаболизма довела их је до метаболизма глукозе. Серија тестова је показала да макрофаги изведени из моноцита са повећаним метаболизмом глукозе и експресијом ГЛУТ1, главног транспортера глукозе, блокирају функцију Т ћелија ослобађањем интерлеукина-10 (ИЛ-10).
Тим је показао да глиобластом ремети метаболизам глукозе у овим макрофагима, узрокујући да они постану имуносупресивни.
Лактилација хистона и њена улога
Истраживачи су открили да кључ имуносупресивне активности макрофага добијених из моноцита повезаних са метаболизмом глукозе лежи у процесу који се назива „лактилација хистона“. Хистони су структурни протеини у геному који играју кључну улогу у експресији гена као што је ИЛ-10 у одређеним контекстима.
Брзом метаболизацијом глукозе, макрофаги изведени из моноцита производе лактат, нуспродукт метаболизма глукозе. Хистони могу постати „лактилирани“ (то јест, лактат је интегрисан у хистоне) тако да хистонска организација промовише експресију ИЛ-10, који производе макрофаги изведени из моноцита да би подржали раст ћелија рака.
Решење проблема
Али како можете зауставити имуносупресивну активност макрофага добијених из моноцита који су повезани са метаболизмом глукозе? Др Веглиа и његов тим су идентификовали могуће решење: ПЕРК, ензим који су идентификовали као регулатор метаболизма глукозе и експресије ГЛУТ1 у макрофагима.
У претклиничким моделима глиобластома, циљање ПЕРК-а је пореметило лактилацију хистона и имуносупресивну активност макрофага, а када се комбинује са имунотерапијом, блокирало је напредовање глиобластома и индуковало дугорочни имунитет који је штитио мозак од поновног раста тумора, што сугерише да циљање ПЕРК-хистона оса лактилације може бити одржива стратегија за борбу против овог смртоносног рака мозга.
