Систем за испоруку лекова затворене петље могао би да побољша хемотерапију
Последње прегледано: 14.06.2024

Сви иЛиве садржаји су медицински прегледани или проверени како би се осигурала што већа тачност.
Имамо стриктне смјернице за набавку и само линкамо на угледне медијске странице, академске истраживачке институције и, кад год је то могуће, медицински прегледане студије. Имајте на уму да су бројеви у заградама ([1], [2], итд.) Везе које се могу кликнути на ове студије.
Ако сматрате да је било који од наших садржаја нетачан, застарио или на неки други начин упитан, одаберите га и притисните Цтрл + Ентер.
Када су пацијенти са раком подвргнути хемотерапији, дозе већине лекова се израчунавају на основу површине тела пацијента. Овај индикатор се процењује помоћу једначине у коју се замењују висина и тежина пацијента. Ова једначина је формулисана 1916. Године на основу података од само девет пацијената.
Овај поједностављени приступ дозирању не узима у обзир друге факторе и може довести до тога да се пацијенту препише превише или премало лека. Као резултат тога, неки пацијенти могу доживети прекомерну токсичност или недостатак ефикасности од своје хемотерапије.
Да би побољшали тачност дозирања хемотерапије, инжењери МИТ-а су развили алтернативни приступ који омогућава да се доза персонализује за сваког пацијента. Њихов систем мери количину лека у телу пацијента, а ти подаци се уносе у контролер, који може да прилагоди брзину инфузије у складу са тим.
Овај приступ може помоћи да се компензују разлике у фармакокинетици лекова узроковане саставом тела, генетском предиспозицијом, токсичношћу органа изазваном хемотерапијом, интеракцијама са другим лековима и храном и циркадијалним флуктуацијама ензима одговорних за разградњу лекова за хемотерапију, кажу истраживачи.
„Препознајући напредак у разумевању начина на који се лекови метаболишу и применом инжењерских алата за поједностављење персонализованог дозирања, верујемо да можемо да помогнемо у трансформацији безбедности и ефикасности многих лекова“, каже Ђовани Траверсо, доцент машинства на МИТ-у и гастроентеролог у болници. Бригхам анд Вомен'с Хоспитал и виши аутор студије.
Луис ДеРидер, дипломирани студент МИТ-а, главни је аутор рада објављеног у Мед.
Континуирано праћење
У овој студији, истраживачи су се фокусирали на лек под називом 5-флуороурацил, који се користи за лечење колоректалног карцинома и друге врсте рака. Лек се обично примењује током периода од 46 сати, а дозирање се одређује помоћу формуле засноване на висини и тежини пацијента, што даје процену телесне површине.
Међутим, овај приступ не узима у обзир разлике у саставу тела, које могу утицати на дистрибуцију лека у телу, или генетске варијације које утичу на његов метаболизам. Ове разлике могу довести до штетних нежељених ефеката ако има превише лека. Ако лек није довољан, можда неће убити тумор како се очекивало.
„Људи са истом површином тела могу имати веома различите висине и тежине, различиту мишићну масу или генетику, али све док висина и тежина у овој једначини дају исту површину тела, њихова доза је идентична,“ каже ДеРиддер, докторски кандидат у програму медицинског инжењерства и медицинске физике на Харвард-МИТ Програму здравствених наука и технологије.
Још један фактор који може да промени количину лека у крви у било ком тренутку је циркадијална флуктуација ензима званог дихидропиримидин дехидрогеназа (ДПД), који разграђује 5-флуороурацил. Експресија ДПД-а, као и многих других ензима у телу, регулисана је циркадијалним ритмом. Дакле, деградација 5-ФУ ДПД није константна, већ варира у зависности од доба дана. Ови циркадијални ритмови могу довести до десетоструких флуктуација у количини 5-флуороурацила у крви пацијента током инфузије.
"Користећи површину тела за израчунавање дозе хемотерапије, знамо да две особе могу имати потпуно различите токсичности од 5-флуороурацила. Један пацијент може имати циклусе лечења са минималном токсичношћу, а затим циклус са страшном токсичношћу. Нешто се променило у томе како се ово Хемотерапија која се метаболише код пацијената из једног циклуса у други Наш застарели метод дозирања не обухвата ове промене и пацијенти пате као резултат“, каже Даглас Рубинсон, клинички онколог на Институту за рак Дана-Фарбер и аутор рада.
Један од начина да се покуша компензовати варијабилност у фармакокинетици хемотерапије је стратегија која се зове терапијско праћење лекова, у којој пацијент даје узорак крви на крају једног циклуса лечења. Након што се овај узорак анализира на концентрације лека, доза се може прилагодити, ако је потребно, на почетку следећег циклуса (обично после две недеље за 5-флуороурацил).
Показано је да овај приступ доводи до бољих исхода за пацијенте, али није широко коришћен за хемотерапије као што је 5-флуороурацил.
Истраживачи са МИТ-а желели су да развију сличан тип праћења, али на аутоматизован начин који би могао да персонализује дозу лека у реалном времену, што би могло да доведе до бољих исхода за пацијенте.
У њиховом систему затворене петље, концентрације лека се могу континуирано пратити и ове информације се користе за аутоматско подешавање брзине инфузије лека за хемотерапију како би се доза одржала унутар циљног опсега.
Овај систем затворене петље омогућава да се дозирање лека персонализује како би се узели у обзир циркадијални ритмови промене нивоа ензима који метаболишу лек, као и све промене у фармакокинетици пацијента од последњег лечења, као што је токсичност органа изазвана хемотерапијом.
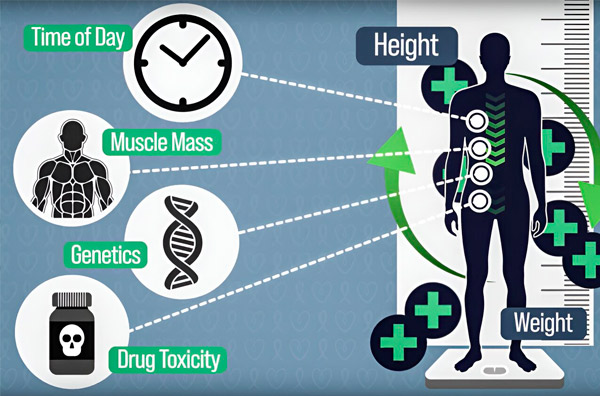
Да би дозирање хемотерапије било прецизније, инжењери МИТ-а развили су начин за континуирано мерење количине лека у телу пацијента током вишечасовне инфузије. Ово ће помоћи да се надокнаде разлике узроковане саставом тела, генетиком, токсичношћу лекова и циркадијалним флуктуацијама. Извор: Обезбедили истраживачи.
Нови систем који су развили истраживачи, познат као ЦЛАУДИА (Цлосед-Лооп АУтоматед Друг Инфусион регулАтор), користи комерцијално доступну опрему за сваки корак. Узорци крви се узимају сваких пет минута и брзо се припремају за анализу. Мери се концентрација 5-флуороурацила у крви и упоређује се са циљним опсегом.
Разлика између циљне и измерене концентрације се уноси у контролни алгоритам, који затим подешава брзину инфузије ако је потребно да би се доза одржала унутар опсега концентрација у којима је лек ефикасан и нетоксичан.
„Развили смо систем у коме можемо континуирано да меримо концентрације лека и прилагођавамо брзину инфузије у складу са тим како бисмо одржали концентрације лека у оквиру терапеутског оквира“, каже ДеРиддер.
Брзо подешавање
У тестовима на животињама, истраживачи су открили да су употребом ЦЛАУДИА-е могли да задрже количину лека који циркулише у телу у циљном опсегу око 45 процената времена.
Нивои лека код животиња које су примале хемотерапију без ЦЛАУДИА су остале у циљном опсегу у просеку само 13 процената времена. У овој студији, истраживачи нису тестирали ефикасност нивоа лека, али се верује да одржавање концентрација унутар циљног оквира доводи до бољих резултата и мање токсичности.
ЦЛАУДИА је такође била у стању да одржи дозу 5-флуороурацила у циљном опсегу чак и када је примењен лек који инхибира ДПД ензим. Код животиња третираних овим инхибитором без сталног праћења и прилагођавања, нивои 5-флуороурацила су се повећали до осам пута.
За ову демонстрацију, истраживачи су ручно извели сваки корак процеса користећи готову опрему, али сада планирају да аутоматизују сваки корак тако да се праћење и прилагођавање дозе могу обавити без људске интервенције.
Да би измерили концентрације лека, истраживачи су користили течну хроматографију-масену спектрометрију високих перформанси (ХПЛЦ-МС), технику која се може прилагодити за откривање практично било које врсте лека.
„Замишљамо будућност у којој можемо да користимо ЦЛАУДИА за било који лек који има одговарајућа фармакокинетичка својства и који се може детектовати помоћу ХПЛЦ-МС, омогућавајући персонализовано дозирање за много различитих лекова“, каже ДеРиддер.
