Нове публикације
Мутација гена ARID1A чини туморе осетљивим на имунотерапију
Последње прегледано: 02.07.2025

Сви иЛиве садржаји су медицински прегледани или проверени како би се осигурала што већа тачност.
Имамо стриктне смјернице за набавку и само линкамо на угледне медијске странице, академске истраживачке институције и, кад год је то могуће, медицински прегледане студије. Имајте на уму да су бројеви у заградама ([1], [2], итд.) Везе које се могу кликнути на ове студије.
Ако сматрате да је било који од наших садржаја нетачан, застарио или на неки други начин упитан, одаберите га и притисните Цтрл + Ентер.
Имунотерапија је последњих година револуционисала лечење рака. Уместо директног циљања тумора, имунотерапија усмерава имуни систем пацијената да ефикасније напада туморе. Ово је посебно ефикасно код неких тешко лечивих карцинома. Међутим, мање од половине свих пацијената оболелих од рака реагује на тренутне имунотерапије, што ствара хитну потребу за идентификацијом биомаркера који могу предвидети који пацијенти ће највероватније имати користи од лечења.
Недавно су научници приметили да пацијенти чији тумори имају мутацију у гену ARID1A имају већу вероватноћу да позитивно реагују на блокаду имунолошких контролних тачака, врсту имунотерапије која делује тако што одржава имуне ћелије које се боре против рака активним.
Пошто је мутација гена ARID1A присутна код многих врста рака, укључујући карцином ендометријума, јајника, колоректалног карцинома, желуца, јетре и панкреаса, истраживачи Института Салк су се питали како би то могло допринети осетљивости на лечење и како би клиничари могли да користе ове информације за персонализацију лечења рака за сваког пацијента.
Њихова нова студија, објављена у часопису Cell, показује да мутација ARID1A чини туморе осетљивим на имунотерапију регрутовањем имуних ћелија које се боре против рака на тумор путем имуног одговора сличног антивирусном.
Истраживачи сугеришу да би се ова мутација и антивирусни имуни одговор могли користити као биомаркер за бољу селекцију пацијената за специфичне имунотерапије, као што је блокада имунолошких контролних тачака. Ови налази такође подстичу развој лекова који циљају ARID1A и сродне протеине како би други тумори били осетљивији на имунотерапију.
„Ово би заиста могло да промени исход лечења рака код пацијената“, рекла је ванредна професорка Дајана Харгривс, виша ауторка студије. „Пацијенти са мутацијом ARID1A већ имају имуни одговор, тако да све што треба да урадимо је да појачамо тај одговор блокадом имуних контролних тачака како бисмо им помогли да униште своје туморе изнутра.“
Иако је било познато да људи са ARID1A мутацијама добро реагују на блокаду имунолошких контролних тачака, тачна веза између њих две остала је нејасна. Да би расветлили механизам, научници са Института Салк користили су мишје моделе меланома и колоректалног карцинома са ARID1A мутацијом и функционалним ARID1A.
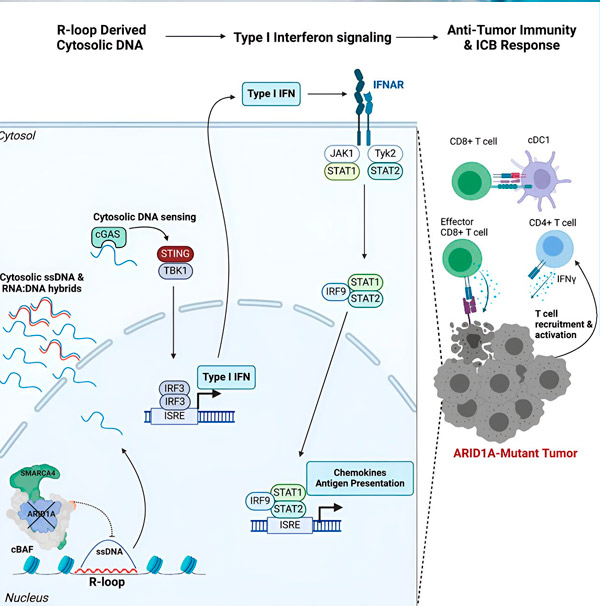
Извор: Cell (2024). DOI: 10.1016/j.cell.2024.04.025
Тим је приметио снажан имуни одговор код свих модела са мутацијом ARID1A, али не и код оних где је ARID1A био функционалан, што подржава идеју да мутација ARID1A заиста покреће овај одговор. Али како ово функционише на молекуларном нивоу?
„Открили смо да ARID1A игра важну улогу у једру одржавајући правилну организацију ДНК“, каже Метју Максвел, први аутор студије и постдипломац у лабораторији Харгривс. „Без функционалног ARID1A, слободна ДНК може бити исечена и ослобођена у цитосол, активирајући пожељан антивирусни имуни одговор који се може појачати блокадом имуних контролних тачака.“
Ген ARID1A кодира протеин који помаже у регулисању облика наше ДНК и одржавању стабилности генома. Када ARID1A мутира, покреће ланац догађаја сличан Рубу Голдбергу у ћелијама рака.
Прво, недостатак функционалног ARID1A доводи до ослобађања ДНК у цитосол. Цитосолна ДНК затим активира антивирусни алармни систем, cGAS-STING пут, јер су наше ћелије прилагођене да обележе било коју ДНК у цитосолу као страну како би се заштитиле од вирусних инфекција. На крају крајева, cGAS-STING пут ангажује имуни систем да регрутује Т ћелије за тумор и активира их у специјализоване Т ћелије убице рака.
У сваком кораку, зависно од претходног, овај ланац догађаја – мутација ARID1A, бекство ДНК, cGAS-STING аларм, регрутовање Т-ћелија – доводи до повећања броја Т-ћелија које се боре против рака у тумору. Блокада имунолошких контролних тачака може се затим користити како би се осигурало да ове Т-ћелије остану активиране, повећавајући њихову способност да победе рак.
„Наши налази пружају нови молекуларни механизам којим мутација ARID1A може допринети антитуморском имунолошком одговору“, каже Харгривс. „Оно што је узбудљиво код ових налаза је њихов транслациони потенцијал. Можемо користити мутације ARID1A за одабир пацијената за блокаду имунолошких контролних тачака, а сада видимо механизам којим лекови који инхибирају ARID1A или његов протеински комплекс могу бити коришћени за даље побољшање имунотерапије код других пацијената.“
Описујући механизам којим је блокада имунолошких контролних тачака ефикаснија код карцинома са ARID1A мутацијом, истраживачи пружају клиничарима образложење за давање приоритета овој имунотерапији код пацијената са ARID1A мутацијом. Ови налази су важан корак ка персонализацији лечења рака и инспиришу развој нових терапија које циљају ARID1A и његов протеински комплекс.
Тим Института Салк се нада да ће њихови налази побољшати исходе лечења пацијената са различитим врстама рака повезаним са мутацијама ARID1A и намерава да истражи ову клиничку транслацију у сарадњи са Универзитетом Калифорније у Сан Дијегу.
