Нове публикације
Наноматеријал који имитира протеине могао би да лечи неуродегенеративне болести
Последње прегледано: 02.07.2025

Сви иЛиве садржаји су медицински прегледани или проверени како би се осигурала што већа тачност.
Имамо стриктне смјернице за набавку и само линкамо на угледне медијске странице, академске истраживачке институције и, кад год је то могуће, медицински прегледане студије. Имајте на уму да су бројеви у заградама ([1], [2], итд.) Везе које се могу кликнути на ове студије.
Ако сматрате да је било који од наших садржаја нетачан, застарио или на неки други начин упитан, одаберите га и притисните Цтрл + Ентер.
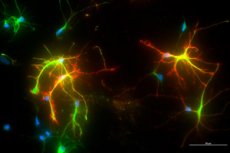
Нови наноматеријал који опонаша понашање протеина могао би бити ефикасан третман за Алцхајмерову болест и друге неуродегенеративне болести. Наноматеријал мења интеракцију између два кључна протеина у можданим ћелијама, што би могло имати снажан терапеутски ефекат.
Иновативни резултати, недавно објављени у часопису Advanced Materials, омогућени су сарадњом научника са Универзитета Висконсин-Медисон и инжењера за наноматеријале са Универзитета Нортвестерн.
Рад се фокусира на промену интеракције између два протеина за које се верује да су укључени у развој болести као што су Алцхајмерова болест, Паркинсонова болест и амиотрофична латерална склероза (АЛС).
Први протеин се зове Nrf2, што је специфична врста протеина названа транскрипциони фактор који укључује и искључује гене унутар ћелија.
Једна од важних функција Nrf2 је његов антиоксидативни ефекат. Иако различите неуродегенеративне болести настају из различитих патолошких процеса, обједињене су токсичним ефектом оксидативног стреса на неуроне и друге нервне ћелије. Nrf2 се бори против овог токсичног стреса у можданим ћелијама, помажући у спречавању развоја болести.
Професор Џефри Џонсон са Фармацеутског факултета Универзитета Висконсин-Медисон и његова супруга, Делинда Џонсон, виши научни сарадник на истом факултету, деценијама проучавају Nrf2 као обећавајућу мету за лечење неуродегенеративних болести. Године 2022, Џонсонови и њихове колеге су открили да повећање активности Nrf2 у одређеном типу можданих ћелија, астроцитима, помаже у заштити неурона код мишјих модела Алцхајмерове болести, што доводи до значајно смањеног губитка памћења.
Иако су претходна истраживања сугерисала да повећање активности Nrf2 може бити основа за лечење Алцхајмерове болести, научници су имали потешкоћа у ефикасном циљању протеина у мозгу.
„Тешко је унети лекове у мозак, али је такође било веома тешко пронаћи лекове који активирају Nrf2 без много нежељених ефеката“, каже Џефри Џонсон.
Сада је стигао нови наноматеријал. Познат као полимер сличан протеину (PLP), синтетички материјал је дизајниран да се веже за протеине као да је сам протеин. Овај наноскопски имитатор је створио тим који је предводио Натан Ђаненки, професор хемије на Универзитету Нортвестерн и члан Међународног института за нанонауку овог универзитета.
Ђанеки је дизајнирао неколико ПЛП-ова који циљају различите протеине. Овај посебан ПЛП је дизајниран да промени интеракцију између Nrf2 и другог протеина названог Keap1. Интеракција ових протеина, или пут, је добро позната мета за лечење многих стања јер Keap1 контролише када Nrf2 реагује на оксидативни стрес и бори се против њега. У нормалним условима, Keap1 и Nrf2 су повезани, али када је под стресом, Keap1 ослобађа Nrf2 да би обављао своју антиоксидативну функцију.
„Баш током разговора, Натан и његове колеге из Гроув Биофарма, стартапа фокусираног на терапијско циљање протеинских интеракција, поменули су Роберту да планирају да циљају Nrf2“, каже Џонсон. „А Роберт је рекао: 'Ако ћеш то да урадиш, требало би да позовеш Џефа Џонсона.'“
Убрзо су Џонсон и Ђаненки разговарали о могућности да лабораторија Универзитета Висконсин-Медисон обезбеди мождане ћелије мишјих модела потребних за тестирање Ђаненкијевог наноматеријала.
Џефри Џонсон каже да је у почетку био помало скептичан према ПЛП приступу, с обзиром на своје непознавање њега и општу тешкоћу прецизног циљања протеина у можданим ћелијама.
„Али онда је један од Нејтанових ученика дошао овде и користио га на нашим мобилним телефонима, и, дођавола, функционисало је заиста добро“, каже он. „Онда смо се заиста позабавили тиме.“
Студија је открила да је Ђанекијев PLP био веома ефикасан у везивању за Keap1, ослобађајући Nrf2 да се акумулира у ћелијским језгрима, побољшавајући његову антиоксидативну функцију. Важно је напоменути да је то учинио без изазивања нежељених споредних ефеката који ометају друге стратегије активације Nrf2.
Иако је овај рад урађен на ћелијама у култури, Џонсон и Ђанеки сада планирају да спроведу сличне студије на мишјим моделима неуродегенеративних болести, линију истраживања коју нису очекивали да ће наставити, али су сада узбуђени да наставе.
„Немамо стручност за рад са биоматеријалима“, каже Делинда Џонсон. „Дакле, добијање овога од Нортвестерна, а затим даљи развој биолошке стране овде на Универзитету у Висконсину показује да су ове врсте сарадње заиста важне.“
