Рестеноза
Последње прегледано: 23.04.2024

Сви иЛиве садржаји су медицински прегледани или проверени како би се осигурала што већа тачност.
Имамо стриктне смјернице за набавку и само линкамо на угледне медијске странице, академске истраживачке институције и, кад год је то могуће, медицински прегледане студије. Имајте на уму да су бројеви у заградама ([1], [2], итд.) Везе које се могу кликнути на ове студије.
Ако сматрате да је било који од наших садржаја нетачан, застарио или на неки други начин упитан, одаберите га и притисните Цтрл + Ентер.
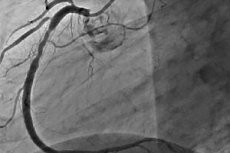
Рестеноза је развој поновног сужења од 50% или више на месту перкутане коронарне интервенције. Рестеноза обично прати релапса ангине, која често захтева поновљене интервенције. Како је ПЦИ еволуирао, инциденција рестенозе се смањила, поред тога, његов карактер се променио.
Рестеноза након транслуминалне балонске коронарне ангиопластике (ТБА)
Након извршења ТБА, инциденција рестенозе у првих 6 месеци. Је 30-40%. Основни механизам његовог развоја је локални негативан адаптација брода, који је већ у ствари, је лумен еластична спадение на артерије, балон проширила током поступка. Релативну улогу игра и локална тромбоза и неоинтимални раст. Алоцирати клиничке (тип 2 дијабетис мелитус, акутни коронарни синдром (АЦС), историја рестеноза), ангиографијом (ЛАД лезију мали пречник посуде, хронични укупан оклузија (хто), дугу лезију, дегенерисане венских графтова) и обрада (висока резидуалне стенозе, мали пораст пречника пловила као резултат инфлације балона) фактори ризика за рестенозу након ТБА. У случају рестенозе, по правилу се врши поновљена интервенција. Успех поновљеног ТБА у месту рестенозе је упоредив са првом процедуром. Међутим, уз сваки следећи ТБЦА за рестенозу, ризик од поновног појаве рестенозе значајно се повећава. После трећег покушаја достиже 50 -53%. Поред тога, при сваком спровођењу поновљеног ТБА, развој рестенозе је израженији од првог. Фактори ризика за развој рестенозе после другог ТБЦА за рестенозу су рано појаве првог рестенозе (60-90 дана након операције), ПНА пораз многососудистос лезија, присуство тип 2 дијабетес мелитус, хипертензија, нестабилну ангину, као мултипла балон инфлације у прва процедуре. С обзиром на високу инциденцу рестенозе, и механизам његовог развоја у клиничкој пракси су уведени коронарних стентова, који теоретски требао елиминатед негативан васкуларни ремоделирање после ТБЦА.
Прве студије које су показале ефикасност употребе стента објављене су 1993. Године, студије СТРЕСС-а и БЕНЕСТЕНТ-а. У БЕНЕСТЕНТ укључивао 516 пацијената са новодијагностикованим стенозе у коронарним артеријама са пречником већи од 3 мм, који су насумично подељени у две групе: редовну ТБЦА (н = 257) ТБЦА и стент (н = 259). Након 3 године, стопа рестенозе са ангиографијом у конвенционалној ТБЦА групи износила је 32%, ау стент групи 22%. Релативно смањење инциденције рестенозе било је 31% (п <0.01). У стентинг групи је такође смањити потребу понављања реваскуларизација миокарда (10 вс 20,6% у групи нормалне ТБЦА п <0.01), која је повезана са мањом инциденцом рецидива ангине у стентинг опсегу.
Према СТРЕС студије (н = 407) у стентинг групи (н ~ 205) рестенорированииа фреквенција је мањи него у конвенционалном ТБЦА групи (н = 202), - 31,6 вс 42,1% (п <0,01 ). Предност коришћења конвенционалног ангиопластике стентови раније у случају рестенозе на месту ТБЦА РЕСТ је показан у студији у којој је 383 болесника са рестенозе насумично стента или ре-перкутане транслуминалне коронарне ангиопластике. Ангиографијом детектовати рестеноза био је нижи за 18% у стента (18 вс 5,32%; п <0,03). Поновљено реваскуларизација миокарда, која представља показатељ клинички значајног рестенозе потребна значајно мања у групи пацијената подвргнутих стентингу (10 вс 27%, п <0.001). Тако су најбољи резултати у примени стента је доказано не само у природном артеријама, али у случају интервенције за рестеноза развој после ТБЦА.
Рестеноза након имплантације откривеног стента (НПЦ)
Иако Непремазни коронарних стентова су смањили инциденцу рестенозе односу на ТБЦА 30-40%, 17 -32% пацијената, чак и после стента рестенозу већ развијен унутар стента, који захтева реваскуларизација. Механизам развоја унутрашње стенозе (ХРВ) разликује се од оног у ТБА. Након стентинга рестенозе главни допринос томе да формирање неоинтиме, а не негативне ремоделирање као у ТБЦА, које у имплантације месту стента практично одсутни. Неоинтима се формира миграцију и пролиферацију ћелија гладкомисхецхпих производњу екстратселлиулиарпи матрицу која заједно са ћелијама и неоинфиме. Поред тога, упорност тромба на месту стента је такође важна код дијабетичара.
Основна подела-стент стеноза (ХРВ) је класификација предложени Мехран, која укључује четири врсте зависности од обима и озбиљности повреда: И ХРВ тип - локални (<10 дужина мм), ИИ тип - дифузну (> 10 мм дужине), ИИИ тип - пролиферативно (> 10 мм и проширење изван стента) и ИВ типа - ХРВ доводи до оклузије. Први тип је подељен на подтипове зависности од локације у стента: 1а - бенд или између стента, 1б - ЕДГЕ, 1ц - унутар стента, 1Д - мултифокална.
Фактори ризика за развој ОМУ су интервентне пас венских графтова, хроничне оклузије, Естуарине лезије, мали пречник посуда, присуство резидуалне стенозе, стента о ВМД, мали пречник постпротседурни вессел, ПНА поражено, велика дужина стента, присуство дијабетеса, имплантације вишеструких стентова у једном пораза . Постоје индикације утицаја генетских фактора, посебно гликопротеина ИИИа полиморфизама и генске мутације метхиленететрахидрофолате редуктаза - гена који кодира интерлеукин-1. У случају ивице стента рестеноза је главни фактор ризика за атеросклеротске лезије изражен у стентируемом сегменту.
Претежно, рестеноза се јавља у првих 6-8 месеци. После перкутане коронарне интервенције. Код већине пацијената у исто време постоје клинички симптоми. Обично се ХРВ манифестује као реакција ангине пекторис. Мање чести (11-41% случајева) постоји нестабилна ангина. Код 1-6% пацијената, АМИ се развија. Дакле, најчешћи узрок ангине у 1-6 месеци. Након стентинга је развој ХРВ-а, који, по правилу, захтева поновну реваскуларизацију. Постоји неколико начина лечења ХРВ-а. Могуће је спровести обична ТБЦА, што доводи до даљег откривања стента (повећање 56% на допринос коначном пречник посуде), а такође гура ћелија кроз стента покожици (44% доприноса коначног повећања пречника). Међутим, у већини случајева, резидуална рестеноза се примећује на месту интервенције (у просеку 18%). Надаље, након ТБЦА реваскуларизација се захтева у 11% случајева, често код пацијената са виаесудовном болешћу, ниска ејекционом фракцијом леве коморе, у случају интервенција венских шантова прва или рана појављивање ХРВ. Ризик развоја развијене ХРВ после ТБЦА зависи и од врсте лезије и опада од 10% у случају локалне рестенозе на 80% са инвазивном оклузијом. Имплантација НПЦ-а уместо ХРВ-а не смањује ризик од поновног појаве у поређењу са само ТБА.
Други начин лечења ХРВ-а је брахитерапија, која се састоји у увођењу у лумен коронарне артерије радиоактивни извор који спречава ширење глатких мишићних ћелија и сходно томе смањује ризик од рестенозе. Ипак, високи трошкови опреме, технички комплексност процедуре и повећана учесталост касне стентне тромбозе (ТЦ) готово потпуно искључују брахитерапију из клиничког коришћења.
Револуционарни тренутак лијечења ВРС-а био је увођење стентова који су узимали дроге. Поређењу са нативним НАП у случају да смањења артеријског 70-80% ризик ХРВ први подаци о СЛП ефикасности код пацијената са већ развијеном ХРВ су добијени код пацијената регистар ТАКСУС ИИИ, где применом СПГ1 ових болесника након 6 месеци. Стопа рецидива ХРВ је била само 16%, што је ниже него у претходно поменутим студијама са ТБА. У ТРУЕ регистру, који је укључивао пацијенте након имплантације АТП-а за рестенозу НПЦ-а, после 9 месеци. Поновљена реваскуларизација захтева мање од 5% пацијената, углавном са дијабетесом и АЦС. ТРОПИЦАЛ Студија упоредио учесталост рестенозе код болесника после имплантације на месту рестеноза ДЕС података Ресеарцх ГАМА И и ГАМА ИИ, у којима је Е као метод третмана примењеног Брахитерапија. После 6 месеци. Инциденција рестенозе била је знатно нижа у АТП групи (9,7 вс 40,3%, п <0,0001). Важно је да учесталост стента тромбозе, инфаркт миокарда такође био нижи у групи АТП (ТС 0.6% вс 3.9, п = 0.08; МИ - 1,8 вс 9,4%, п = 0,004). Предност АТП претходног брахитерапије је потврђена у рандомизованој СИСР студији у којој су 384 болесника са утврђеном ХРВ у ХПЦ случајном АТП или Брахитерапија имплантацију. После 9 месеци. Потреба за понављање реваскуларизација је већа после брахитерапије (19,2%) него у групи усађена ПЦА (8,5%), одражавајући чешћу рецидива рестенозу. Након 3 године, АТП предност у смислу смањења потреба за поновљеним реваскуларизација за повратни стента рестенозе упоран (19 вс 28,4%). Није било значајне разлике у учесталости тромбозе између група.
Главни фактори за понављања ХРВ код болесника са НПЦ у случају АТП имплантације су малог пречника вессел (<2,5 мм), дифузни тип рестенозу, као и присуство хроничног оштећења бубрега која захтева дијализу. У случајном суђења Такус В ИСР ЦПР такође показали високу ефикасност у лечењу ХРВ, смањујући Брахитерапија поређењу са учесталошћу рецидива рестенозе од 54%.
Рандомизиране студије су такође изведене упоређујући ефикасност ТБА за имплантацију ХРВ и СЛП. У рандомизираној студији РИБС-ИИ након 9 месеци. Поновљена рестеноза била је 72% мање честа након имплантације СЛП него након ТБА, што је смањило потребу за поновном реваскуларизацијом са 30 на 11%. У студији ИСАР ДЕСИРЕ, ефикасност ТБА у ХРВ-у упоређена је са имплантацијом СПП или АТП. После 6 месеци. Показало да су БЛТ ефикасније спречавају рестенозу од ТБЦА (стопа развоја је 44,6% у ТБЦА, 14,3% у АТП групи и 21,7% у групи ЦПР), што је смањило потребу за поновљене реваскуларизације. У директном поређењу ППС-а и АТП-а, показало се да АТПс смањују потребу за поновном реваскуларизацијом знатно ефикасније него ППС (8 против 19%). Стога, имплантације СЛП смањује појаву рецидива ХРВ НПС поређењу и са ТБЦА и брахитерапије, што смањује број ретрансмисија чини ПЦИ и самим поступак имплантације избора код ових болесника.
Рестеноза након имплантације стента који елуира дрогом (СЛП)
Упркос 70-80% смањењу инциденције интра-стеналне стенозе приликом употребе СЛП у поређењу са НПЦ-има, нису могли у потпуности искључити развој овог јатрогеног ефекта стента. Његова укупна фреквенција остаје у просјеку мање од 10%. Поред квантитативног смањења инциденције рестенозе, они су такође значајно променили врсту рестенозе која се формира. Дакле, после имплантације СЛП, рестеноза је, по правилу, фокална. Клинички, као иу случају НПС, најчешће се манифестује као релапс стабилне ангине пекторис (77%), мање ређе (8%), није асимптоматски. У 5% случајева манифестује нестабилну ангину, а код 10% - први симптом је нон-К-миокардијални инфаркт. Главни фактори за развој СЛП рестенозе су дијабетес типа 2, мали пречник посуде, као и степен лезије. Јасне препоруке везане за управљање таквим пацијентима не. Алтернативе понављају имплантацију СЛП (истог типа или другог типа), провод ТБА или брахитерапију. Просјечна учесталост развоја рестенозе током имплантације друге СЛП је 24%, док је исти у случају имплантације исте врсте СЛП или другог.


 [
[