Медицински стручњак за чланак
Нове публикације
Вирус хумане имунодефицијенције (ХИВ)
Последње прегледано: 04.07.2025

Сви иЛиве садржаји су медицински прегледани или проверени како би се осигурала што већа тачност.
Имамо стриктне смјернице за набавку и само линкамо на угледне медијске странице, академске истраживачке институције и, кад год је то могуће, медицински прегледане студије. Имајте на уму да су бројеви у заградама ([1], [2], итд.) Везе које се могу кликнути на ове студије.
Ако сматрате да је било који од наших садржаја нетачан, застарио или на неки други начин упитан, одаберите га и притисните Цтрл + Ентер.
Синдром стечене имунодефицијенције је идентификован као специфична болест 1981. године у Сједињеним Државама, када је један број младих људи развио озбиљне болести изазване микроорганизмима који су били непатогени или слабо патогени за здраве људе. Студија имуног статуса пацијената открила је нагло смањење броја лимфоцита уопште, а посебно Т-хелпера. Ово стање је названо СИДА (синдром стечене имунодефицијенције). Начин инфекције (сексуални контакт, путем крви и њених препарата) указивао је на заразну природу болести.
Узрочника АИДС-а открили су 1983. године независно Француз Л. Монтање, који га је назвао LAV вирус повезан са лимфаденопатијом, пошто га је пронашао код пацијента са лимфаденопатијом; и Американац Р. Гало, који је вирус назвао HTLV-III (људски Т-лимфотропни вирус III): претходно је открио лимфотропне вирусе I и II.
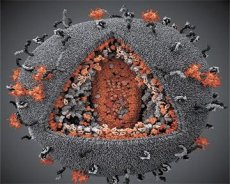
Поређење својстава вируса LAV и HTLV-III показало је њихов идентитет, па је, да би се избегла забуна, вирус 1986. године назван HIV (вирус хумане имунодефицијенције или HIV). HIV је сферног облика, пречника 110 nm. Омотач вируса има облик полиедра, састављеног од 12 петоугаоника и 20 шестоугаоника. У центру и угловима сваког шестоугаоника налази се молекул гликозилираног протеина gpl20 (број 120 означава молекулску тежину протеина у килодалтонима). Укупно 72 молекула gpl20 налазе се на површини вириона у облику необичних шиљака, од којих је сваки повезан са интрамембранским протеином gp41. Ови протеини, заједно са двоструким липидним слојем, формирају суперкапсид (мембрану) вириона.
Протеини gpl20 и gp41 настају пресецањем прекурсорског протеина Env ћелијском протеазом. Протеин gp41 формира „стабло“ шиљка везивањем својим цитоплазматским доменом за матрични протеин p17MA који се налази директно испод омотача. Молекули p17 интерагују током сазревања вириона и формирају икосаедар испод омотача.
У централном делу вириона, протеин p24 формира капсид у облику конуса. Сужени део капсида је повезан са мембраном вириона уз учешће протеина rb. Унутар капсида налазе се два идентична молекула вирусне геномске РНК. Они су својим 5' крајевима повезани са нуклеокапсидним протеином p7NC. Овај протеин је занимљив јер има два аминокиселинска остатка (мотива) богата цистеином и хистидином и садрже атом Zn - називају се „цинкови прсти“ јер хватају молекуле геномске РНК ради укључивања у формирајуће вирионе. Капсид такође садржи три ензима. Ревертаза (RT), или pol комплекс, укључује реверзну транскриптазу, RNase H и ДНК-зависну ДНК полимеразу. Ревертаза је присутна као хетеродимер p66/p51. Протеаза (PR) - p10, покреће и спроводи процес сазревања вириона. Интеграза (IN) - p31, или ендонуклеаза, обезбеђује укључивање провирусне ДНК у геном ћелије домаћина. Капсид такође садржи молекул прајмерске РНК (tRNAl"3).
РНК геном у ћелији се уз помоћ реверзне транскриптазе претвара у ДНК геном (ДНК провирус), који се састоји од 9283 пара нуклеотида. Ограничен је са леве и десне стране такозваним дугим терминалним понављањима, или LTR-овима: S'-LTR са леве и 3'-LTR са десне стране. LTR-ови садрже по 638 парова нуклеотида.
Геном ХИВ-а се састоји од 9 гена, од којих се неки преклапају на крајевима (имају неколико оквира за читање) и имају егзонинтронски облик. Они контролишу синтезу 9 структурних и 6 регулаторних протеина.
Значај LTR-ова за вирусни геном је у томе што садрже следеће регулаторне елементе који контролишу његово функционисање:
- транскрипциони сигнал (промоторски регион);
- поли-А адициони сигнал;
- сигнал за ограничавање;
- интеграциони сигнал;
- сигнал позитивне регулације (TAR за TAT протеин);
- негативни регулаторни елемент (NRE за NEF протеин);
- место за везивање прајмера РНК (тРНК™3) за синтезу минус-ланца ДНК на 3' крају; сигнал на 5' крају LTR који служи као прајмер за синтезу плус-ланца ДНК.
Поред тога, LTR садржи елементе који учествују у регулацији сплајсинга иРНК, паковања молекула vРНК у капсид (Psi елемент). Коначно, током транскрипције генома, у дугим иРНК се формирају два сигнала за REV протеин, који пребацују синтезу протеина: CAR - за регулаторне протеине и CRS - за структурне протеине. Ако се REV протеин веже за CAR, синтетишу се структурни протеини; ако је одсутан, синтетишу се само регулаторни протеини.
Следећи регулаторни гени и њихови протеини играју посебно важну улогу у регулисању функционисања вирусног генома:
- ТАТ протеин, који врши позитивну контролу вирусне репликације и делује преко ТАР регулаторног региона;
- NEV и VPU протеини, који врше негативну контролу репликације кроз NRE регион;
- REV протеин, који спроводи позитивно-негативну контролу. REV протеин контролише рад gag, pol, env гена и спроводи негативну регулацију сплајсинга.
Дакле, репликација ХИВ-а је под троструком контролом - позитивном, негативном и позитивно-негативном.
VIF протеин одређује инфективност новосинтетисаног вируса. Повезан је са капсидним протеином p24 и присутан је у вириону у количини од 60 молекула. NEF протеин је у вириону представљен малим бројем молекула (5-10), могуће повезаних са омотачем.
VPR протеин инхибира ћелијски циклус у G2 фази, учествује у транспорту преинтеграционих комплекса у ћелијско једро, активира неке вирусне и ћелијске гене и повећава ефикасност репликације вируса у моноцитима и макрофагима. Локација VPR, TAT, REV и VPU протеина у вириону није утврђена.
Поред сопствених протеина, вирионска мембрана може да садржи и неке протеине ћелије домаћина. VPU и VPR протеини учествују у регулацији вирусне репродукције.
Антигене варијанте вируса хумане имунодефицијенције (ХИВ)
Вирус хумане имунодефицијенције (ХИВ) је веома варијабилан. Чак и из тела једног пацијента могу се изоловати сојеви вируса који се значајно разликују по антигеним својствима. Такву варијабилност олакшава интензивно уништавање CD4+ ћелија и снажан одговор антитела на ХИВ инфекцију. Нови облик ХИВ-а, ХИВ-2, биолошки близак ХИВ-1, али имунолошки другачији од њега, изолован је од пацијената из Западне Африке. Хомологија примарне структуре генома ових вируса је 42%. ДНК провирус ХИВ-2 садржи 9671 bp, а његова LTR - 854 bp. ХИВ-2 је накнадно изолован у другим регионима света. Не постоји унакрсни имунитет између ХИВ-1 и ХИВ-2. Позната су два велика облика ХИВ-1: О (Outlier) и М (Major), при чему је други подељен на 10 подтипова (AJ). Осам подтипова (AH) циркулише у Русији.
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
Механизам интеракције ХИВ-а са ћелијом
Након што продре у тело, вирус прво напада ћелије које садрже CD4 рецептор специфичан за њега. Овај рецептор је присутан у великим количинама у Т-хелперима, у мањим количинама у макрофагима и моноцитима, а Т-хелпери су посебно осетљиви на вирус.
Вирус хумане имунодефицијенције (ХИВ) препознаје CD4 рецепторе користећи свој gpl20 протеин. Процес интеракције ХИВ-а са ћелијом одвија се према следећој шеми: адсорпција посредована рецептором -> обложена јама -> обложена везикула -> лизозом. У њој се вирионска мембрана спаја са лизозомском мембраном, а нуклеокапсид, ослобођен од суперкапсида, улази у цитоплазму; на путу до једра, он се уништава, а геномска РНК и придружене компоненте језгра се ослобађају. Затим, реверзна транскриптаза синтетише минус ланац ДНК на вирионској РНК, затим РНаза Х уништава вирионску РНК, а вирусна ДНК полимераза синтетише плус ланац ДНК. 5'-LTR и 3'-LTR се формирају на крајевима ДНК провируса. ДНК провирус може неко време остати у једру у неактивном облику, али пре или касније се интегрише у хромозом циљне ћелије уз помоћ своје интегразе. У њему, провирус остаје неактиван све док дати Т-лимфоцит не буде активиран микробним антигенима или другим имунокомпетентним ћелијама. Активацију ћелијске ДНК транскрипције регулише посебан нуклеарни фактор (NF-kB). То је протеин који везује ДНК и производи се у великим количинама током активације и пролиферације Т-лимфоцита и моноцита. Овај протеин се везује за одређене секвенце ћелијске ДНК и сличне LTR секвенце ДНК провируса и индукује транскрипцију и ћелијске ДНК и ДНК провируса. Индуковањем транскрипције ДНК провируса, врши се прелазак вируса из неактивног стања у активно и, сходно томе, из перзистентне инфекције у продуктивну. Провирус може остати у неактивном стању веома дуго. Активација вируса је критичан тренутак у његовој интеракцији са ћелијом.
Од тренутка када вирус продре у ћелију, почиње период ХИВ инфекције - стање носиоца вируса, које може трајати 10 година или више; а од тренутка када се вирус активира, почиње болест - СИДА. Уз помоћ својих регулаторних гена и њихових продуката, вирус почиње активно да се размножава. ТАТ протеин може повећати брзину репродукције вируса за 1000 пута. Вирусна транскрипција је сложена. Она обухвата формирање и иРНК пуне дужине и субгеномске иРНК, сплајсовање иРНК, а затим долази до синтезе структурних и регулаторних протеина.
Синтеза структурних протеина се одвија на следећи начин. Прво се синтетише прекурсорски полипротеин Pr55Gag (протеин молекулске тежине 55 kDa). Он садржи 4 главна домена: матрични (MA), капсидни (CA), нуклеокапсидни (NC) и rb домен, из којег се, као резултат сечења Pr55Gag вирусном протеазом (сам се сече од другог прекурсорског протеина, Gag-Pol), формирају структурни протеини p17, p24, p7 и rb, респективно. Формирање полипротеина Pr55Gag је главни услов за формирање вирусних честица. Управо овај протеин одређује програм морфогенезе вириона. Он секвенцијално укључује фазе транспорта Gag полипротеина до плазма мембране, интеракције са њом и интеракције протеин-протеин током формирања вирусне честице и њеног пупљења. Pr55Gag се синтетише на слободним полирибозомима; молекули протеина се транспортују до мембране, где су усидрени својим хидрофобним регионима. CA домен игра главну улогу у стварању нативне конформације Gag протеина. NC домен обезбеђује укључивање (уз помоћ својих „цинкових прстију“) 2 молекула геномске РНК у састав формирајуће вирусне честице. Молекул полипротеина се у почетку димеризује због интеракције матричних домена. Затим се димери комбинују у хексамерне (од 6 јединица) комплексе као резултат интеракције CA и NC домена. Коначно, хексамери, спајајући се на својим бочним површинама, формирају незреле сферне вирионе, унутар којих се налази геномска вирусна РНК, заробљена од стране NC домена.
Још један прекурсорски протеин, Prl60Gag-Pol (протеин молекулске тежине 160 kDa), синтетише се као резултат померања оквира читања рибозомом током транслације 3'-краја gag гена у региону који се налази непосредно узводно од региона који кодира rb протеин. Овај Gag-Pol полипротеин садржи непотпуну Gag протеинску секвенцу (1-423 аминокиселине) и Pol секвенце које укључују PR, RT и IN домене. Молекули Gag-Pol полипротеина се такође синтетишу на слободним полирибозомима и транспортују се до плазма мембране. Prl60Gagpol полипротеин садржи сва места интермолекуларне интеракције и места везивања за мембрану својствена Gag полипротеину. Стога се молекули Gag-Pol полипротеина спајају са мембраном и, заједно са Gag молекулима, укључују се у формирајуће вирионе, што резултира појавом активне протеазе и почетком процеса сазревања вириона. HIV-1 протеаза је високо активна само у облику димера, стога је за њено самоизбацивање из Prl60Gag-Pol потребна димеризација ових молекула. Сазревање вириона се састоји у томе што ослобођена активна протеаза сече prl60Gag-Pol и Gag55 на местима која она препознаје; формирају се протеини p17, p24, p7, p6, ревертаза, интеграза и долази до њиховог удруживања у вирусну структуру.
Енв протеин се синтетише на рибозомима повезаним са мембранама ендоплазматског ретикулума, затим се гликозилује, ћелијска протеаза га сече на гп120 и гп41 и транспортује на површину ћелије. У овом случају, гп41 продире кроз мембрану и везује се за матриксне домене молекула Гаг протеина повезаног са унутрашњом површином мембране. Ова веза је очувана у зрелом вириону.
Дакле, склапање вирусних честица састоји се од агрегације прекурсорских протеина и придружених молекула РНК на плазма мембрани ћелије домаћина, формирања незрелих вириона и њиховог ослобађања пупљењем са површине ћелије. Током пупљења, вирион се окружује ћелијском мембраном у коју су уграђени молекули gp41 и gp120. Током пупљења или, могуће, након ослобађања вириона, долази до њиховог сазревања, које се спроводи уз помоћ вирусне протеазе и састоји се од протеолитичког сечења прекурсорских протеина Pr55Gag и Prl60Gag-Pol у протеине зрелог вируса и њиховог удруживања у одређене структурне комплексе. Водећу улогу у процесима вирусне морфогенезе игра прекурсорски полипротеин Pr55Gag, који организује и склапа незрели вирион; процес његовог сазревања завршава специфична вирусна протеаза.
Узроци имунодефицијенције
Један од главних узрока имунодефицијенције код ХИВ инфекције је масовна смрт Т-хелпера. Она се јавља као резултат следећих догађаја. Прво, Т-хелпери заражени вирусом умиру услед апоптозе. Верује се да су код пацијената са СИДОМ репликација вируса, апоптоза и смањење броја Т-хелпера међусобно повезани. Друго, Т-убице препознају и уништавају Т-ћелије заражене вирусом или које носе адсорбоване молекуле gpl20, као и Т-хелпере заражене и неинфициране вирусом, који формирају симпласте (синцитијум) који се састоје од неколико десетина ћелија (неке од њих умиру као резултат репродукције вируса у њима). Као резултат уништења великог броја Т-хелпера, долази до смањења експресије мембранских рецептора у Б-лимфоцитима за интерлеукин-2, поремећена је синтеза различитих интерлеукина (фактори раста и диференцијације Б-лимфоцита - IL-4, IL-5, IL-6, итд.), што резултира поремећајем функције Т-килер система. Активност комплементарног и макрофагног система је потиснута. Макрофаги и моноцити заражени вирусом не умиру дуго времена, али нису у стању да уклоне вирус из организма. Коначно, због структурне и антигенске сличности gpl20 са рецепторима неких епителних ћелија тела (укључујући рецепторе трофобласта који посредују у преносу ХИВ-а путем трансплантације), синтетишу се антирецепторска антитела широког спектра деловања. Таква антитела су у стању да блокирају различите ћелијске рецепторе и компликују ток болести аутоимуним поремећајима. Последица ХИВ инфекције је пораз свих главних карика имуног система. Такви пацијенти постају беспомоћни против широког спектра микроорганизама. То доводи до развоја опортунистичких инфекција и тумора. Код пацијената са ХИВ инфекцијом повећава се ризик од развоја најмање три врсте рака: Капошијев сарком; карцином (укључујући рак коже); Б-ћелијски лимфом, који настаје услед малигне трансформације Б-лимфоцита. Међутим, ХИВ није само лимфоцитотропан, већ и неуротропан. Продире у ћелије централног нервног система (астроците) и рецептор-посредованом ендоцитозом и фагоцитозом вирусом заражених лимфобласта од стране астроцита. Када вирус интерагује са астроцитима, формирају се и симпласти, који олакшавају ширење патогена кроз међућелијске канале. Вирус може дуго да перзистира у макрофагима и моноцитима, па они служе као резервоар и дистрибутери истог у телу, способни да продру у сва ткива. Заражени макрофаги играју главну улогу у уношењу ХИВ-а у централни нервни систем и његовом оштећењу. Код 10% пацијената, примарни клинички синдроми су повезани са оштећењем централног нервног система и манифестују се као деменција. Дакле, особе заражене ХИВ-ом карактеришу 3 групе болести - опортунистичке инфекције,туморске болести и оштећења централног нервног система.
Епидемиологија ХИВ инфекције
Извор ХИВ инфекције је само особа - болесна особа или носилац вируса. Вирус хумане имунодефицијенције (ХИВ) се налази у крви, сперми, цервикалној течности; код дојиља - у мајчином млеку. Инфекција се јавља сексуално, путем крви и њених препарата, као и са мајке на дете пре, током и после порођаја. Случајеви инфекције вирусом путем хране, пића и уједа инсеката нису познати.
Зависност од дрога доприноси ширењу АИДС-а. Учесталост ХИВ-а расте сваке године. Према подацима СЗО, од 1980. до 2000. године, 58 милиона људи је инфицирано ХИВ-ом. Само у 2000. години, 5,3 милиона људи је инфицирано широм света, а 3 милиона људи је умрло од АИДС-а. Закључно са 1. јануаром 2004. године, у Русији је регистровано 264 хиљаде ХИВ-инфицираних особа. Половина људи инфицираних ХИВ-ом умире у року од 11-12 година од тренутка инфекције. Почетком 2004. године, од сваких 100 хиљада грађана Русије, око 180 је живело са дијагнозом „ХИВ инфекција“. Предвиђа се да ће са овим нивоом морбидитета укупан број ХИВ-инфицираних особа у Русији до 2012. године бити 2,5-3 милиона људи. Сложеност борбе против ХИВ инфекције зависи од низа разлога: прво, не постоје ефикасне методе њеног лечења и специфичне превенције; друго, период инкубације за ХИВ инфекцију може бити већи од 10 година. Његово трајање зависи од тренутка активације Т-лимфоцита и ДНК провируса садржаног у његовом хромозому. Још увек није јасно да ли је свако ко је заражен вирусом осуђен на СИДУ или је могуће дугорочно ношење вируса без болести (што делује мало вероватно). Коначно, постоји неколико вируса хумане имунодефицијенције (HIV-1, HIV-2), чије антигенске разлике спречавају формирање унакрсног имунитета. Откриће вируса мајмунске имунодефицијенције (SIV) бацило је светло на питање порекла HIV-а. SIV је сличан HIV-у по организацији генома, али се значајно разликује по нуклеотидној секвенци. HIV-2 заузима средњи положај између HIV-1 и SIV по својим серолошким својствима, а ближи је SIV-у по својој нуклеотидној секвенци. У том смислу, В. М. Жданов је сугерисао да вируси HIV-1, HIV-2 и SIV потичу од заједничког претка. Могуће је, према Р. Галу, да је један од СИВ-ова некако ушао у људско тело, где је претрпео низ мутација, што је резултирало појавом ХИВ-1, ХИВ-2 и његових других облика.
Симптоми ХИВ инфекције
Вирус хумане имунодефицијенције има неке карактеристике које у великој мери одређују патогенезу болести. Вирус има веома високу стопу репродукције, одређену његовим регулаторним елементима (у активној фази се синтетише до 5.000 вириона за 5 минута). Због присуства фузионог протеина (gp41), вирус индукује формирање опсежних синцицијалних структура услед фузије инфицираних и неинфицираних Т-помоћних ћелија, што резултира њиховом масовном смрти. Молекули протеина gpl20 формирани у великим количинама слободно циркулишу у крви и везују се за рецепторе неинфицираних Т-помоћних ћелија, услед чега их такође препознају и уништавају Т-убице. Вирус се може ширити међућелијским каналима од ћелије до ћелије, у ком случају постаје тешко доступан антителима.
Клинички критеријуми за ХИВ инфекцију
Код одраслих, ХИВ инфекција се дијагностикује када имају најмање два озбиљна симптома у комбинацији са најмање једним мањим симптомом и у одсуству других познатих узрока имунодефицијенције (рак, конгенитална имунодефицијенција, тешко гладовање итд.). Озбиљни симптоми укључују:
- губитак тежине од 10% или више;
- продужено фебрилно стање, повремено или константно;
- хронична дијареја.
Мањи симптоми: упорни кашаљ, генерализовани дерматитис, рекурентни херпес зостер, орална и фарингеална кандидијаза, хронични херпес симплекс, генерализована лимфаденопатија. Дијагноза АИДС-а се поставља у присуству само Капошијевог саркома, криптококног менингитиса, пнеумоцистне пнеумоније. На клиничку слику болести утиче пратећа опортунистичка инфекција.
Методе култивације вируса хумане имунодефицијенције (ХИВ)
ХИВ-1 и ХИВ-2 могу се култивисати у ћелијама само једног клона ТЦВ4 лимфоцита - Х9, добијеног из леукемијских ТЦВ4 лимфоцита. У ове сврхе могу се користити и монослојне културе астроцитних ћелија, у којима се ХИВ-1 добро репродукује. Шимпанзе су подложне ХИВ-1 међу животињама.
Отпорност вируса у спољашњој средини је ниска. Угине под утицајем сунчеве светлости и УВ зрачења, уништава се на 80 °C у року од 30 минута, када се третира уобичајено коришћеним дезинфекционим средствима - у року од 20-30 минута. За дезинфекцију материјала који садржи вирус, неопходно је користити микобактерицидна дезинфекциона средства, јер су ефикасна против микроорганизама са највећом отпорношћу.
Лабораторијска дијагностика ХИВ инфекције
Главна метода за дијагностиковање вирусоносаштва и ХИВ инфекције је ензимски имунотест. Међутим, због чињенице да gpl20 има структурну и антигенску сличност са рецепторима неких људских ћелија, укључујући рецепторе који транспортују имуноглобулине кроз епителне ћелије слузокоже, у телу се могу појавити антитела сродна антителима против gpl20. У овом случају, могу постојати лажно позитивни ELISA резултати. Стога, сви позитивно реагујући серуми испитаника подвргавају се додатној анализи коришћењем имуноблотинг методе, односно Western blotting-а. Ова метода се заснива на идентификацији антитела која се испитују након њиховог електрофоретског раздвајања и накнадног тестирања коришћењем обележених антиспецијских антитела. Виролошки метод се ретко користи због сложености култивације вируса. Клон H9 лимфоцита се користи за добијање вирусних антигена - неопходних компоненти дијагностичких тест система. CPR метода омогућава детекцију вируса у раној фази виремије.
Лечење ХИВ инфекције
Потребно је пронаћи или синтетизовати лекове који ефикасно сузбијају активност реверзне транскриптазе (ревертазе) или вирусне протеазе. Они би спречили формирање ДНК провируса и/или инхибирали интрацелуларну репродукцију вируса. Савремена стратегија лечења ХИВ-инфицираних пацијената заснива се на принципу комбиноване употребе лекова који инхибирају вирусну протеазу (један од лекова) и реверзазу (2 различита лека) - комбинована (трострука) терапија. У Русији се за лечење ХИВ-инфицираних пацијената препоручује комбинована употреба 2 домаћа лека: фосфазида и криксивана, који специфично сузбијају репродукцију ХИВ-а у раним и касним фазама репродукције, посебно са смањеном активношћу азидотимидина.
Проблем специфичне профилаксе је потреба за стварањем вакцине која би осигурала формирање ефикасног ћелијског имунитета заснованог на цитотоксичним лимфоцитима специфичним за вирус, без значајне производње антитела. Такав имунитет обезбеђују Thl помоћници. Могуће је да антитела, укључујући и она која неутралишу вирус, нису само неефикасна у сузбијању HIV инфекције, већ на високом нивоу сузбијају ћелијски имунитет. Стога, анти-HIV вакцина мора да испуни, пре свега, два главна захтева: а) да буде апсолутно безбедна и б) да стимулише активност T-цитотоксичних лимфоцита. Проучава се ефикасност различитих варијанти вакцине добијених од убијених (инактивираних) вируса и од појединачних антигена са високим заштитним својствима. Такви антигени могу бити изоловани из самих вириона или хемијски синтетизовани. Предложена је вакцина креирана на основу метода генетског инжењеринга. То је рекомбинантни вирус вакциније који носи HIV гене одговорне за синтезу антигена са јаким имуногеним својствима. Питање ефикасности ових вакцина захтева значајно време због дугог периода инкубације HIV инфекције и велике варијабилности патогена. Стварање високо ефикасне вакцине против HIV-а је хитан фундаментални проблем.

