Патогенеза хепатитиса Б
Последње прегледано: 19.11.2021

Сви иЛиве садржаји су медицински прегледани или проверени како би се осигурала што већа тачност.
Имамо стриктне смјернице за набавку и само линкамо на угледне медијске странице, академске истраживачке институције и, кад год је то могуће, медицински прегледане студије. Имајте на уму да су бројеви у заградама ([1], [2], итд.) Везе које се могу кликнути на ове студије.
Ако сматрате да је било који од наших садржаја нетачан, застарио или на неки други начин упитан, одаберите га и притисните Цтрл + Ентер.
У патогенези хепатитиса Б могу се разликовати неколико водећих веза патогеног ланца:
- увођење патогене - инфекције;
- фиксација на хепатоцит и пенетрација у ћелију;
- умножавање вируса и "гурање" на површину хепатоцита, али и у крв;
- укључивање имунолошких реакција усмјерених на елиминацију патогена;
- имунокомплексна лезија органа и система;
- формирање имунитета, ослобађање од патогена, опоравак.
Пошто се инфекција хепатитисом Б увек јавља парентерално, можемо претпоставити да је тренутак инфекције скоро еквивалентан пенетрацији вируса у крв. Покушаји неких истраживача да изолују у ентералној и регионалној фази хепатитиса Б слабо су утемељени. Постоји више разлога да се верује да је са крвотоком вирус одмах ушао у јетру.
Тропизам хепатитиса Б вируса у ткиву јетре у присуству унапред одређене посебног састава ХБсАг рецептора - полипептид који има молекулску тежину од 31 000 Да (РЗ1) који има активност везивања албумина. Слично албумин и зона се налази на мембрани хепатоцита људских и шимпанзе јетри него суштински дефинисане тропизма и ХБВ на људска и шимпанзе јетри.
Са продирање вируса у хепатоцитима ослобађају вирусне ДНК која улази у хепатоцита језгро и делујући као шаблон за синтезу нуклеинских киселина, покреће низ узастопних биолошких реакција, чији резултат ће бити вирус нуклеокапсидну склоп. Нуклеоцапсид се мигрира кроз нуклеарну мембрану у цитоплазму, где се одржава коначна монтажа честица Дане - укупан вирус хепатитиса Б.
Треба напоменути, међутим, да када је хепатоцит инфициран, процес може да иде на два начина - репликативан и интегративан. У првом случају, развија се слика акутног или хроничног хепатитиса, ау другом случају вирус који носи.
Узроци који унапред утврђују два типа интеракције вируса ДНК и хепатоцита нису управо утврђени. Највероватније је врста одговора генетски одређена.
Резултат интеракције постало репликативно структуре монтажни коровского антиген (у језгру) и комплетан склоп вируса (у цитоплазми) праћено презентацијом потпуног вируса или њених антигена на мембрани или у мембране структури хепатоцита.
Сматра се да репликација вируса не доводи до оштећења ћелија на нивоу хепатоцита, јер вирус хепатитиса Б нема цитопатски ефекат. Оваква ситуација не може сматрати сигуран, јер се базира на експерименталним подацима који, иако нема доказа о цитопатског ефекта вируса хепатитиса Б, али произведен у култури ткива, и зато не могу у потпуности екстраполиран на вирусног хепатитиса Б код људи. У сваком случају, питање одсуства лезије хепатоцита током репликативне фазе захтева додатну студију.
Међутим, без обзира на природу интеракције вируса са ћелијом, у даљем тексту јетре нужно укључене у иммунопатхологицал процесу. Тако хепатоцита оштећења због чињенице да је експресија вирусних антигена на мембрани хепатоцита и ослобађање вирусних антигена у слободној циркулације кругу је укључен узастопна ћелијских и хуморални имунског одговора усмереним у крајњем уклањање вируса ит организма. Овај процес се одвија у потпуном складу са општим законима имуног одговора на вирусне инфекције. За отклањање патогена обухватају цитотоксичне ћелијске одговоре посредоване различитим класама еффецтор ћелија К-ћелије, Т ћелије, ћелије природне убице, макрофагима. Током ових реакција је уништавање заражених хепатоцита, што је праћено ослобађањем вирусних антигена (ХБцАг, НВеАг, ХБсАг), окидање система антитела, при чему специфична антитела акумулирати у крви, нарочито краве - анти-ХБц анд е антиген - анти-ХБЕ . Због тога, ослобађање јетре ћелија вирусом јавља у току њене смрти услед реакције ћелијског цитолизу.
Истовремено, специфична антитела која се акумулирају у крви везују антигене вируса, формирају имунске комплексе фагоцитозе макрофагама и секретују их бубрези. Стога могу постојати различити иммуноцомплек лезија као гломерулонефритис, артеритис, бол у зглобовима, осип на кожи, и други. Пошто је учешће специфичних антитела је очишћена организам од патогена и постоји потпуни опоравак.
У складу са горе наведеним концепта патогенезе хепатитиса Б сви многоструки клиничке варијанте болести предузете да објасни карактеристике интеракције вируса и имуне ћелије подизвођача, другим речима, моћ имуног одговора на присуство вирусних антигена. Према савременим идејама, јачина имунолошког одговора је генетски одређена и повезана са антигеном хистокомпатибилности првог класе ХЛА локуса.
Опште је мишљење да је у условима адекватног имунолошког одговора на антигене вируса акутни хепатитис са цикличним током и комплетним опоравком клинички развијен. Уз смањење имуног одговора на антигене изражене вирусном имуно-посредоване цитолизу мало, тако не постоји ефикасна елиминација инфицираних ћелија јетре, што доводи до клиничких манифестација блага са продуженим постојаности вируса и може се развити хронични хепатитис. У овом случају, напротив, у случају генетски одређује снажан имуни одговор и масивност инфекције (трансфузије крви) Узрок уништавање зоне јетре ћелије, које одговарају клинички тешком и малигне облика болести.
Приказана схема патогенезе хепатитиса Б је значајна за његову хармонију, ипак, у њему постоји низ контроверзних и мало истражених момената.
Ако следимо концепт хепатитиса Б као имунопатолошке болести, могли бисмо очекивати повећање реакција на ћелијску цитотоксичност с повећањем тежине болести. Међутим, у тешким облицима, индекси ћелијске везе имунитета су оштро редуковани, укључујући вишеструки пад, у поређењу са онима код здравих дјеце и индекс цитотоксичности К-ћелија. Када малигни облик приликом развоја масовне некрозе јетре и секреције коми нарочито изражено потпуне немогућности да експлозије трансформацију лимфоцита под утицајем фитогематтлиутинина, Стапхилоцоццус ендотоксин и ХБсАг. Штавише, не постоји способност леукоцита да мигрира према реакције леукоцита миграције инхибиције (РТМЛ), и открио драматично повећање пропустљивост мембране лимфоцита из студија им са флуоресцентном пробом тетрациклин.
Стога, ако индикаторе флуоресценције лимфоцитима здравих људи су 9,9 ± 2%, а са типичном хепатитисом Б са бенигним Наравно, они повећан за 22,3 ± 2,7%, затим број малигних облика флуоресцентних лимфоците достиже у просеку 63,5 ± 5,8%. Пошто повећање пермеабилности ћелијских мембрана недвосмислено вредновани у литератури као поуздан показатељ функционалног инвалидитета, може се закључити да хепатитис Б, а нарочито у малигном облику, бруто оштећење настаје лимфоците. То такође потврђују индикатори цитотоксичне активности К-ћелија. У тешким 1-2 недеље цитотоксичности болести 15,5 ± 8,8%, док је за малигне форме 1. Седмице - 6,0 ± 2,6, на 2. - 22,0 ± 6,3% у норма је 44,8 ± 2,6%.
Наведени подаци јасно показују израженије сметње у ћелијској имунитет код пацијената са тешком хепатитисом Б. Такође је јасно да ове промене дешавају други пут, што доводи до пораза имунокомпетентних ћелија од токсичних метаболита и евентуално циркулишућих имуних комплекса.
Студије су показале да код пацијената са тешком хепатитисом, посебно у случају масовног некрозе јетре, крвни серум је пад титар ХВсАг и НВеАг и истовремено почињу да се детектује у високим титра антитела до површинског антигена, што је доста необично за бенигну облика болести, када је који се анти-ХБВ појављују само у 3-5 месецу болести.
Убрзано нестајање хепатитис Б вирусних антигена са истовременим појавом високих антивирусних антитела титар указује велико формирање имуних комплекса и њихово евентуално учешће у патогенези масивног хепатална некроза.
Тако, стварни материјали не дозвољавају да јединствено третман хепатитиса Б само са становишта иммунопатхологицал агресије. И то није само чињеница да ово није нашао везу између дубине и обима морфолошких промена у јетри, с једне стране, и степену ћелијских фактора имунитета - на другој страни. У теорији, та чињеница може објаснити касније студије целуларног имунитета, имуних ћелија, када се подвргне моћним токсичних ефеката услед повећања квара јетре. Можете, наравно, претпостављају да је имуни цитолиза хепатоцита јавља у најранијем стадијуму инфекције, можда чак и пре појаве клиничких симптома озбиљних обољења јетре. Међутим, таква претпоставка је вероватно јер се у болесника са акутном (муње) тока болести открила сличне индексе целуларног имунитета и, додатно, морфолошка студија ткива јетре није пронађен масивну лимфоцитна инфилтрација истовремено детектује континуирани теренски некротично епител без знакова ресорпције и лимфоцитне агресија.
Објашњење морфолошке слике код акутног хепатитиса само са становишта цитолизе имуних ћелија је веома тешко, па у раним радовима није искључено цитотоксично дејство вируса хепатитиса Б.
Тренутно, ова претпоставка је делимично потврђена открићем студија вируса хепатитиса Б су показали да је учесталост детекције маркера хепатитиса Д је директно пропорционална са озбиљности болести: благи форма се налазе у 14%, умерено - 18 год, тешка - 30 малигни - код 52% пацијената. С обзиром да хепатитис Д вирус има некрозогенним цитопатски ефекат, утврђено је да је у развоју фулминант облика хепатитиса Б коинфекције од великог значаја вируси хепатитиса Б и Д.
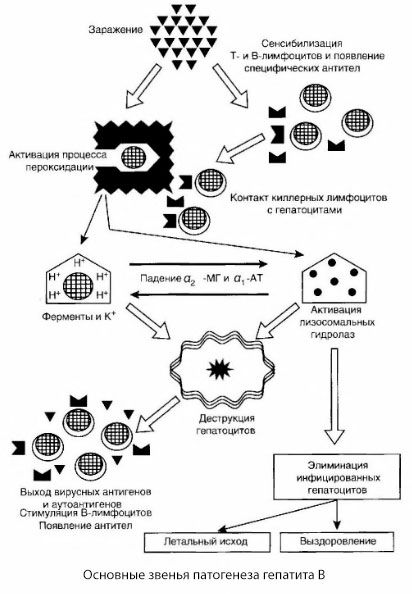
Патогенеза хепатитиса Б може се представити на следећи начин. Након пенетрације вируса хепатитиса Б у хепатоците, на инфициране хепатоците Т-убица изазива имунолошки напад, који ослобађа лимфотоксине према хепатичким ћелијама.
Интимни механизми оштећења хепатоцита код хепатитиса Б још нису успостављени. Водећу улогу играју активирани процеси липидне пероксидације и лизозомских хидролаза. Полазна тачка може бити лимфотоксини који се ослобађају из ефекторских ћелија када дођу у контакт са хепатоцитима, али је могуће да сам вирус може бити иницијатор процеса реоксидације. У будућности се патолошки процес највероватније развија у следећем низу.
- Интерацтион оф фактора агресије (лимпхотокинс или вируса) са биолошким макромолекула (евентуално са компонентама мембрани ендоплазматског ретикулума, способна да учествује у процесу детоксикације, по аналогији са другим штетним агенсима, као што је показано у вези са угљен тетрахлорид).
- Формирање слободних радикала, активација процеса липидне пероксидације и повећање пропустљивости свих хепатоцелуларних мембрана (синдром цитолизе).
- Кретање дуж градијента концентрације биолошки активних супстанци - губитак ензима различитих субћелијских локализација, донаторе енергију, калијума, итд нагомилавања ћелија у натријума, калцијума, пХ помак према интрацелуларног ацидозе ..
- Активација и принос лизозомских хидролаза (РНА-асе, ДНК-асе, катепсини, итд.) Са пропадањем хепатичне ћелије и ослобађањем аутоантигена.
- Стимулација имуног Т- и Б-система са формирањем специфичног Т лимфоцита сензибилизацији на хепатиц липопротеина и противопецхеноцхних хуморални формирање аутоантитела.
У предложеном шеми патогенези хепатитиса Б као окидач фактора су вирусни антигени чији интензивни производи примећено у најранијим фазама болести и читавог акутном периоду, осим малигних облика у којима производња вирусних антигена је готово зауставља у моменту масивног хепатиц некрозе, шта претходи брзо смањење репликације вируса.
Такође је евидентно да вирусни антигени активирају Т- и Б-систем имунитета. Током овог процеса постоји карактеристика прерасподела субпопулација Т-лимфоцита усмереним на организацију адекватног имуног одговора, елиминација инфицираних хепатоцита, неутрализација вирусних антигена, и опоравак саногенесис
У реакцији имуних ћелија на вирусне антигене на хепатоцитима или мембране у току репликације у хепатоцитима, постоје услови за активацију липидне пероксидације, контролни као што је познато, пропустљивост ћелијских и субћелијских мембране,
Из ове перспективе постаје разумљиво да је таква природна и високо карактеристична за појаву виралног хепатитиса синдрома цитолизе - повећана пропустљивост ћелијских мембрана
Коначни исход синдрома цитолизе може бити потпуна дисоцијација оксидативне фосфорилације, одлив ћелијског материјала, смрт хепатичног паренхима.
Међутим, у највећем броју случајева, ови процеси не стичу такав фаталан развој. Само у малигним облицима патолошког процеса болести јавља као лавина, и неповратно, зато што постоје масивне инфестације означен имуног процеса, прекомерна активација обрађује оверокидатион и лизозомне гидродаз Пхеномена аутоимуни агресију.
Ови исти механизми посматрати са повољном курсу од хепатитиса Б, једино својство да се спроводе на квалитативно другачијем нивоу. За разлику од случајева масивне хепатална некрозе, са повољном клинички ток инфицираних хепатоцита и отуда подручје иммунопатхологицал цитолизу мање липидне пероксидације амплификован није толико значајан, активација киселих хидролаза доводи само до ограниченог аутолизе са занемарљивим ослобађањем аутоантигенима и следствено, без масовног само-агресије, односно све фазе патогенезе са повољном курсу спроводи у оквиру текућег структурне организације пас ренхими јетре и ограничени заштитни системи (антиоксидансе, инхибиторе, итд) и стога нема такву штетно дејство.
Узроци симптома интоксикације код виралног хепатитиса нису у потпуности истражени. Предлог разликовати тзв примарни или вирусном, интоксикације и секундарни (замена или метаболички) може се сматрати позитивним, иако не открива интимне механизам опште токсичног синдрома. Прво, вируси хепатитиса немају токсична својства, и друго, концентрација многих метаболита не одговара увек тежини болести и степену симптома токсикозе. Такође је познато да концентрација вирусних антигена није стриктно у корелацији са тежином интоксикације. Обрнуто, са повећањем тежине болести и стога повећати степен токсичности, ХБсАг концентрације смањује и најнижи у малигним формама у време дубоке хепатиц коме. Међутим, фреквенција детекције и титри специфичних антивирусних антитела директно зависе од тежине болести.
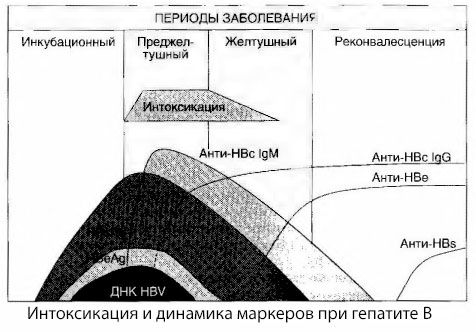
Интоксикације појављује не у време регистрације вирусних антигена, а период антивирусни крви циркулација ИгМ антитела на антиген и антиген коровскому систем Е. Штавише, када се појаве тешке и нарочито малигних облика значајан део пацијента крви и анти-ХБС који обично никада није примећивао благе и умерене облике болести.
Представљени података омогућава да се закључи да је синдром токсикоза вирусног хепатитиса и хепатитиса Б посебно не настају као последица вирусних антигена у крви и последица интеракције вирусних антигена са антивирусних ИгМ антителима. Резултат такве интеракције, како је познато, је формирање имуних комплекса и, евентуално, активних токсичних супстанци.
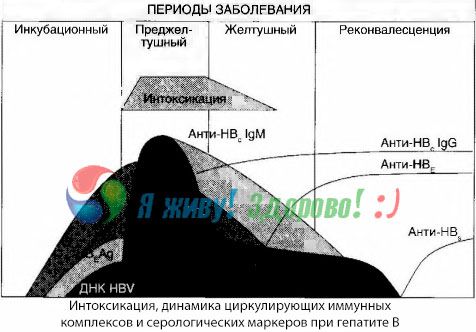
Симптоми интоксикације се јављају у време појављивања имуних комплекса у слободном промету, али у будућности таква корелација не може се пратити.
Делимично објашњење за ово може се наћи у проучавању састава имунских комплекса. Код пацијената са тешким крв циркулише претежно средњих система, а њиховом саставу на висини од синдром токсичног доминације класе антитела док је у рецесији, и клиничких манифестација системима за издвајање постају веће, и оне почињу да доминирају састав ИгГ антитела.
Приказани подаци се односе на механизме развоја токсичног синдрома у иницијалном периоду болести, али са токсикозом која се јавља на висини клиничких манифестација, они су само од парцијалног значаја, а посебно код развоја хепатичне коме.
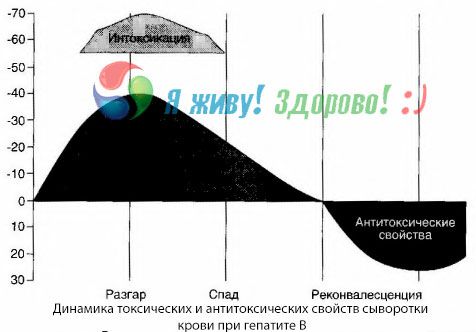
По методу хемокултура могуће је показати да код хепатитиса Б, крв непрекидно акумулира токсине који се ослобађају од погођеног пропадања хепатичног ткива. Концентрација ових токсина је пропорционална тежини болести, оне су протеинске природе.
У периоду опоравка, антитела на овај токсин се појављују у крви; али у случају хепатичне коме, концентрација токсина у крви нагло порасте, а антитела у крви нису откривена.
Патоморфологија хепатитиса Б
По природи морфолошких промена постоје три облика акутног хепатитиса Б:
- циклична форма,
- масивна некроза јетре;
- холестатски перицхолангиолитички хепатитис.
Када циклични облик хепатитиса Б дегенеративног, упалних и пролиферативних промена су израженији у лобулес овог центра, док хепатитис А се налазе на периферији кришке, ширења до центра. Ове разлике се објашњавају различитим начинима пенетрације вируса у паренхиму јетре. Хепатитис А вирус улази у јетру кроз в.порте и протеже се средишту лобулес, хепатитис Б вирус улази кроз јетре артерије и капилари гранања равномерно снабдева све сегменте до центру.
Степен поражености паренхима јетре у већини случајева одговара озбиљности клиничких манифестација болести. У блажим облицима обично се фокалне некрозе хепатоцита, а на умереним и тешким облицима - зонског некрозе (са тенденцијом ка формирању фузионих мостова и некрозе у тешким облицима болести).
Највеће морфолошке промене паренхима се примећују на висини клиничких манифестација, који се обично поклапају са првом деценијом ове болести. Током 2. И посебно треће деценије, процеси регенерације су интензивирани. До тог тренутка, некробиотске промене скоро потпуно нестају и почињу да преовладавају процеси ћелијске инфилтрације са спорим накнадним обнављањем структуре плоча ћелија хепатитиса. Међутим, потпуна обнова структуре и функције хепатичног паренхима се јавља тек 3 до 6 месеци након појаве болести, а не свих пацијената.
Генерализована инфекције хепатитисом Б и потврђени детекцији ХБсАг, не само у хепатоцитима, али и у бубрегу, плућа, слезине, панкреаса, коштане сржи и др.
Холестатска (перихолангиолитицхески) хепатитис - посебан облик болести, у којој су највеће морфолошке промене детектовати стране интрахепатичних жучним путевима, и са слике холангиолита перихолангиолита. Уз холестатичку форму, холестаза се развија с повећањем жучних капилара са стазом жучи у њима, са пролиферацијом холангиола и ћелијским инфилтратима око њих. Хепатичне ћелије са овом формом хепатитиса су благо погођене. Клинички, болест се одликује дуготрајним путем са продуженом жутицом. Показано је да је узрок оваквог посебног тока болести доминантни ефекат вируса на зидове холангиола са незнатним дејством на хепатоците.

