Улога промена у субхондралној кости у патогенези остеоартритиса
Последње прегледано: 19.10.2021

Сви иЛиве садржаји су медицински прегледани или проверени како би се осигурала што већа тачност.
Имамо стриктне смјернице за набавку и само линкамо на угледне медијске странице, академске истраживачке институције и, кад год је то могуће, медицински прегледане студије. Имајте на уму да су бројеви у заградама ([1], [2], итд.) Везе које се могу кликнути на ове студије.
Ако сматрате да је било који од наших садржаја нетачан, застарио или на неки други начин упитан, одаберите га и притисните Цтрл + Ентер.
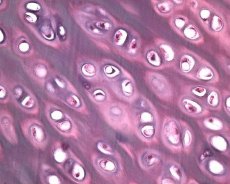
Поред дегенерације зглобне хрскавице, патолошки процес у остеоартритису укључује ткиво испод костију. Предлаже се да згушњавање субхондралне плоче промовише прогресију остеоартритиса. Како напредује остеоартритис, зглобна хрскавица, која је предмет механичког и хемијског стреса, полако је еродирана услед неравнотеже у процесима катаболизма и поправке хрскавице. Конкретно, механичко оптерећење у односу на "тежину" телесне масе спојева доприноси стварању великог броја микро-прелома у субхондралној плочи и хрскавици. Како ерикуларна хрскавица еродира, склероза субхондралне кости напредује, крутост коштаног ткива се повећава, што за узврат доприноси даљем поремећају артикуларне хрскавице. Међутим, питање примарне или секундарне природе промена у субхондралној кости код остеоартрозе остаје неријешено.
До недавно се сматрало да су секундарне карактеристике радиографски утврђене промене у спужвастој супстанци субхондралне кости, попут склерозе или формирања циста код пацијената са остеоартритисом. Међутим, резултати клиничких и експерименталних студија указују на могућу иницијативну улогу субхондралне кости у патогенези остеоартритиса. Један могући механизам је оштро повећање нагиба крутости субхондралне кости због чињенице да интегритет правилног хрскавичног ткива зависи од механичких особина костног "кревета". Студије примата показале су да промене у субхондралној кости могу претходити промјенама у зглобној хрскавици. Докази у моделима остеоартрозе код животиња и клиничке студије доказа у прилог овој хипотези и против њега само су погоршали дискусију. Устојање трабекуле у субхондралној кости није увек праћено повећањем минерализације коштаног ткива, односно повећањем запремине остеоида. Овај знак абнормалне минерализације указује на то да је поремећај у регулацији преуређивања костију саставни део остеоартрозе, а такође подржава концепт дефекта коштаног ткива код остеоартритиса. Група Ј. Декуекер (1989) сматра ову другу као "генерализовану метаболичку болест костију".
Коштано ткиво се стално ажурира. Овај динамички процес, који се зове ремоделовање костију, представља сложен низ процеса процене ресорпције и минерализације. Остеокласти ресорбирају коштано ткиво и остеобласти издвајају протеине који чине главну органску компоненту за минерализацију. Образовање и ресорпција кости случајно наишао скелета, то је - програмирани процес који се одвија у различитим деловима скелета, познатих као преуређење костију јединице. На почетку циклуса остеокласти се појављују на неактивној површини; У року од 2 седмице они формирају тунел у слоју коштаног костију или лакуну на површини трабекуларне кости. Учесталост активације нових јединица за преуређивање костију одређује степен опоравка коштаног ткива. У здравој младој особи процеси формирања и ресорпције коштаног ткива су уравнотежени, нормална маса коштаног ткива се одржава. Хормонални регулација ресорпције костију најмање ПТХ и ПГЕ 2, присуствовали не само остеокласта и остеобласта, већ као дејства ових хормона су пуштени фактора који стимулишу ресорпцију костију по остеокласта. Тренутно постоји више од 12 локалних и системски регулатор раста костију штетних ремоделирање, нарочито ПТХ, 1,25 (ОХ) 2 Д 3, калцитонин, хормона раста, глукокортикоиди, тироидни хормони, инсулин, ИГФ (1 анд 2), естрогени, ПГЕ 2, андрогени.
Ћелијске ћелије ослобађају бројне протеине и цитокине, које спроводе ендокрину регулацију и пренос сигнала. Протеини који производе остеобласти укључују протеине костних матрица као што су колаген, остеопонтин, остеокалцин, сијалопротеини костију. Поред тога, ове ћелије ослободи протеаза у оба активна и латентна, који учествују у коштаној процесу Ремоделинг - ММП, компоненте активатор плазминогена система (ПА) / плазмин. Цитокини ослобођени остеобластима могу дјеловати и преко аутокриналних механизама и паракрина до локалних ћелија (остали остеобласти, остеокласти).
Још није познато на који начин се ови сигнали регулишу - механичким напрезањем или другим хемијским сигналима индукованим механичким стресом. Међутим, познато је да поновљено механичко стресање изазива локалну пролиферацију коштаних ћелија и / или протеина. Под условима ин виво механичка оптерећења способан да активира остеобласта, да се повећа ниво цикличних нуклеотида производњу простагландина и индукују морфолошке промене повезане са ремоделирање костију. Под условима ин витро механичког стреса изазива остеобласт пролиферацију културе, мРНК експресију коштаних протеина укључених у формирању остеоид минерализације иу процесу, ослобађање локалних фактора раста, као што је ИГФ-1 и ИГФ-2, и адхезионих молекула. Пренос сигнала механичког напона може се постићи путем механички осјетљивих јонских канала.
Постоје индиректни докази о поремећену функцију остеобласта у остеоартритису. Г. Геверс анд Ј. Декуекер (1987) су показали пораст у серуму остеокалцин код жена са остеоартритисом зглобова руку, као експлантата кортикалног подручје коштаног, што сугерише да је патологија коштаног ткива може бити део остеоартритиса. Код аутопсије није откривено само згушњавање субхондралне кости, већ и абнормално ниска минерализација главе фемура. Код морских свиња са остеоартритисом изазваним хирургијом, утврђено је значајно задебљање костне фракције у субхондралној зони користећи рачунарску томографију. Неравнотежа између колагених и не-колагена (остеокалцин итд) Протеинс може повећати обим костију, али не утиче на његов минералну густину. Према М. Схимизу ет ал (1993), напредовања дегенеративних промена зглобне хрскавице вези са интензивнијом ремоделацијом субцхондрал кости и повећава чврстину, који такође указује дефект у коштане ћелије код остеоартритиса. Према предложеним В. Лее анд М. АСПДЕН (1997) хипотеза о неисправног пролиферације коштаних ћелија може довести до повећања тврдоће костију, али не изазивају пораст у минералне густине.
ЦИ Вестацотт и коаутори (1997) су претпоставили да абнормални остеобласти директно утичу на метаболизам ткива хрскавице. Култивисање остеобласта код болесника са остеоартритиса хондроцитима са људима који немају болести зглобова, аутори приметили значајну промену у ослобађању глукозаминогликана нормалног хрскавице ткива ин витро, али ниво цитокина остала непромењена. Г. Хилал ет ал (1998) су показали да култура остеобласта субцхондрал боне пацијената са остеоартритиса ин витро има измењен метаболизам - Систем Ацтивити АП / плазмин и ИГФ-1 у овим ћелијама је повећана. Запажање ЦИ Вестацотт и сар. (1997) се може објаснити повећањем активности протеазе у субхондралним костним ћелијама.
Остаје непознато да ли остеоартритис покреће промене у субцхондрал кости и допринесе њеном напредовању? ДК Дедрицк ет ал (1993) су показали да код паса са хируршки индуковане остеоартритис субцхондрал кости згушњавање није предуслов за развој остеоартрозподобних промена у зглобне хрскавице, већ доприноси прогресији дегенеративних процеса у хрскавице. Резултати студије А. Са'иед ет ал (1997) су у супротности са претходним студијама. Користећи ецхограпхи 50 МХз за евалуацију иницијалних морфолошких промена и њихово напредовање у зглобне хрскавице и кости код експерименталних ињекција остеоартритиса индукованог моноиодуксуснои киселине у зглоб колена пацова смо показали симултани процес промене у кости и хрскавице током прва три дана након ињекције.
Остеобласти лучи факторе раста и цитокине који учествују у локалној ремоделирање коштаног ткива, што може допринети ремоделирање хрскавице у одговарајућем "тежине носач" зглобова након њиховог продирања кроз микро у калцификоване слоју хрскавице. Штавише, производи синтезе коштане ћелије налазе се у синовијалној течности. Највероватнији производи лучи абнормалних остеобласта способне да остварују локалну процес ремоделирања хрскавицу су ТГФ-Б и БОНЕ морфометријских беланчевине (ИЛЦ). Обе су представник породице ТГФ додијељен и хондроцитима и остеобласта, и оба могу да модификују како костима, и хрскавицу. Ј. Мартел Пеллетиер ет ал (1997) приметили повећање нивоа ТГФ-П у субцхондрал кости експлантата остеоартритис пацијенте у поређењу са здравим појединцима, што указује на могућу улогу овог фактора раста у патогенези остеоартритиса. ИГФ се такође производи од остеобласта. У култури остеобласта налик ћелијама изведеним из пацијената са остеоартритиса, фоунд повећање нивоа ИГФ који мењају метаболизам хрскавице.
ТГФ-б, ИГФ, Комисија и цитокини које производе остеобласта у субцхондрал кости може да утиче на производњу колагеназе и других протеолитичких ензима у хрскавици, што заузврат може допринети ремоделирања / разградње матрикса хрскавице. Остаје нејасно да ли су остеобласта производе ОА мањи фактор стимулације колоније макрофага (М-ЦСФ - а стимулатор коштане ресорпције) од нормалних ћелија. Ресеарцх ресултс АГ Уиттерлинден и сарадници (1997) су показали да улогу у формирању остеофити рецептора може играти витамина Д, које су изразила остеобласта и регулишу експресију неколико фактора синтетисани од стране ових ћелија, што делимично објашњава улогу остеобласта у патогенези ове болести.
С обзиром на резултате наведених студија, Г. Хилал ет ал (1998), Ј. Мартел-Пеллетиер ет ал (1997) су предложили следећи радна хипотеза однос ремоделовање субцхондрал кости и зглобне хрскавице одговарајућу код остеоартритиса. У раној или проширеној фази патогенезе ОА интензивира се процес ремоделирања коштаног ткива у субхондралној кости. Истовремено понавља оптерећење доводи до локалне микропукотине и / или појаве система неравнотежа ИГФ / ИГФ-свиазиваиусхи протеин (ИГФБП) због ненормалног одговора остеобласта субцхондрал коштане која промовише њену склерозу. Последње може допринијети појављивању микро-прелома одговарајуће хрскавице и оштећењу матрице.
У нормалним условима ова оштећења се елиминишу локалном синтезом и ослобађањем ИГФ-1 и ИГФ-везујућег протеина, који стимулишу стварање ЕЦМ-а умрежене хрскавице. Истовремено, ПД систем промовира раст субхондралних костних ћелија и формирање костне матрице. Анаболички активност ИГФ-система повећана субцхондрал кост код остеоартритиса пацијената, док локални активација СА система / плазмин (локално регулатор ИГФ-система) у зглобне хрскавице узрокује своје локалне измене. У остеобласта код остеоартритиса ИГФ-1 даје регулисање АП типа плазмин позитивним повратним, стога могу да инхибирају ремоделирање коштаног ткива, што је на крају доводи до субцхондрал склерозом. Тако, у кости и хрскавице локално индукцијом ИГФ-1 ипротеаз доводи, с једне стране, оштећење хрскавице, друга - на задебљање субцхондрал кости, други у заузврат промовира нова оштећења хрскавице. Неравнотежа између оштећења хрскавице повезана са субцхондрал склероза и њен капацитет поправке, доводи до прогресивним променама у хрскавице ЕЦМ и за развој остеоартритиса. Према ауторима, ова хипотеза такође објашњава споро прогресију болести.

