Медицински стручњак за чланак
Нове публикације
Генетски и метаболички аспекти патогенезе остеоартритиса
Последње прегледано: 08.07.2025

Сви иЛиве садржаји су медицински прегледани или проверени како би се осигурала што већа тачност.
Имамо стриктне смјернице за набавку и само линкамо на угледне медијске странице, академске истраживачке институције и, кад год је то могуће, медицински прегледане студије. Имајте на уму да су бројеви у заградама ([1], [2], итд.) Везе које се могу кликнути на ове студије.
Ако сматрате да је било који од наших садржаја нетачан, застарио или на неки други начин упитан, одаберите га и притисните Цтрл + Ентер.
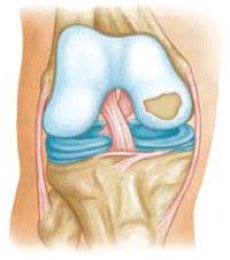
Улога механичких фактора у патогенези остеоартритиса је неоспорна, али постоје убедљиви докази да се неки облици остеоартритиса наслеђују према Менделовим законима. Наследне остеоартропатије се могу поделити на:
- примарни генерализовани остеоартритис (ПГАО),
- артропатије повезане са кристалима,
- превремени остеоартритис због наследне остеохондродисплазије.
Године 1803. В. Хеберден је описао „благо густе чворове, величине малог грашка“ на дорзалној површини дисталних интерфалангеалних зглобова руку. Овај симптом, према аутору, разликује остеоартритис од других болести зглобова, укључујући гихт. Ј. Хајагарт (1805) је проширио клинички опис Хеберденових чворова, приметивши њихову честу повезаност са артрозом других локализација. Касније је Бушар описао сличне чворове на дорзалној површини проксималних интерфалангеалних зглобова руку. Користећи термин „Хеберденови и Бушарови чворови“, В. Осијер је разликовао „хипертрофични артритис“ и „деформишући артритис“ (1909). Године 1953. Р. М. Штечер и Х. Херш су открили преваленцију Хеберденових чворова међу члановима породице и закључили да се наслеђују аутозомно доминантно. Накнадне студије након открића Р. М. Штечера и Х. Херша откриле су повезаност Хеберденових и Бушарових чворова са дегенеративним лезијама других зглобова. На основу података клиничког прегледа и HLA типизације, JS Lawrence (1977), JS Lawrence и др. (1983) сугерисали су присуство полигеног наслеђивања, а не дефект једног гена.
Фенотипски спектар наследног остеоартритиса значајно варира од благих облика који постају клинички очигледни тек у касној одраслој доби до веома тешких облика који се манифестују у детињству. Традиционално, сви ови облици су класификовани као секундарни остеоартритис. Сада је познато да су неки од ових фенотипова узроковани мутацијама у генима који кодирају макромолекуле зглобне хрскавице ECM, што нарушава интегритет хрскавичаве матрице и регулацију пролиферације хондроцита и експресије гена. Ове наследне болести представљају посебну подгрупу остеоартритиса која се разликује од секундарног остеоартритиса.
Разлике између наследног и секундарног остеоартритиса (према Вилијамсу Ц.Ј. и Хименезу С.А., 1999)
Наследни остеоартритис |
Секундарни остеоартритис |
|
Етиологија |
Мутација гена експримираних у зглобној хрскавици |
Разне наследне и стечене болести |
Патогенеза |
Оштећење структурних или функционалних компоненти зглобне хрскавице |
Секундарне манифестације болести, које не утичу увек само на зглобну хрскавицу |
Лечење |
Генска терапија може бити могућа за исправљање генског дефекта |
Лечење основне болести |
Хондродисплазија/остеохондродисплазија је група клинички хетерогених болести које карактеришу абнормалности у расту и развоју зглобне хрскавице и плоче раста. Неке ХД/ОКД доводе до раног развоја остеоартритиса, клинички окарактерисаног тешким током. Међу њима се могу разликовати следеће болести:
- спондилоепифизна дисплазија (СЕД),
- Стиклеров синдром,
- дисплазија Книста,
- мултипла епифизна дисплазија (МЕД),
- метафизна хондродисплазија (МЦД),
- неке ото-спондило-мета-епифизне дисплазије (OSMED).
Наследне дисплазије које карактерише остеоартритис са раним почетком (према Вилијамсу Ц.Ј. и Хименезу С.А., 1999)
Болест |
Локус |
Врста наслеђивања |
Мутирани ген |
Врста мутације |
Рани остеоартрит са касним почетком сензитивне енцефалопатије (СЕД)* |
12q13.1-q13.2 |
ПАКАО |
КОЛ 2 А, |
Супституција, уметање, делеција база |
Стиклеров синдром (STL1) |
12q13.1-q13.2 |
ПАКАО |
COL2A1 |
Замена основе, уметање |
Стиклеров синдром (STL2) |
6р21.3 |
ПАКАО |
КОЛА |
Уметање, брисање |
Стиклеров синдром |
1п21 |
ПАКАО |
КОЛА |
Замена основе |
Вагнеров синдром |
12q13.1-q13.2 |
ПАКАО |
КОУА, |
Замена основе |
ОСМЕД |
6р21.3 |
Проширена стварност |
КОЛА |
Замена основе |
Маршалов синдром |
1п21 |
ПАКАО |
КОЛА |
Уметни |
Книста дисплазија |
12q13.1-q13.2 |
ПАКАО |
КОЛА |
Уметање, брисање |
М3фл (ЕДМ1) |
19р13.1 |
ПАКАО |
КОМПАНИЈА |
Замена основе |
МЕД (ЕДМ 2) |
1р32.2-рЗЗ |
ПАКАО |
КОЛА |
Уметни |
МЦДС |
6q21-q22.3 |
ПАКАО |
КОЛА |
Супституција база, делеција |
МЦДЈ Јансен |
Зр21.2-р21.3 |
ПАКАО |
ПТХР, |
Замена основе |
*Симболи локуса су дати у заградама; AD - аутозомно доминантан; AR - аутозомно рецесиван.
Спондилоепифизна дисплазија
Спондилоепифизне дисплазије (СЕД) обухватају хетерогену групу болести са аутозомно доминантним типом наслеђивања, које карактерише абнормални развој аксијалног скелета и тешке промене у епифизама дугих цевастих костију, често узрокујући патуљасти раст. СЕД често има тежак клинички ток, праћен скраћивањем тела и, у мањој мери, удова.
Код облика ЕДС-а који се манифестују у каснијем узрасту, фенотип је често мало промењен и можда се клинички не манифестује све до адолесценције, када се развија тешка остеоартроза. Деформација лумбалне кичме може се манифестовати као сужавање интервертебралних дискова, платиспондилија и мања кифосколиоза. Такође се откривају аномалије епифиза у периферним зглобовима и ране дегенеративне промене у њима. Најконстантнији знак оштећења периферних зглобова је спљоштење зглобних површина скочног и коленског зглоба, као и спљоштење интеркондиларног жлеба фемура. Аномалије главе и врата фемура се често откривају са развојем остеоартрозе кука, манифестујући се у адолесценцији.
Пошто је колаген типа II главна компонента хијалинске хрскавице, издана је претпоставка да је ген који га кодира, COL1A, узрок ЕДС-а. Први опис генетске везе између фенотипа раног остеоартритиса повезаног са касним почетком ЕДС-а и гена проколагена типа II, COL 2 A, датира из 1989. и 1990. године. Први извештај о мутацији COL 2 A код рођака са раним остеоартритисом повезаним са касним почетком ЕДС-а укључивао је супституцију базе Arg519>Cys. До данас су идентификоване још четири породице са сличним мутацијама. Код чланова друге породице са раним остеоартритисом и благим ЕДС-ом, пронађена је супституција базе Arg75>Cys, иако фенотип ЕДС-а код чланова ове породице није сличан фенотипу породице са супституцијом аргинина у цистеин на позицији 519. Друге мутације COL 2 A-Gly976>Ser, Gly493>Ser такође су пронађене код чланова породица са ЕДС-ом. Ј. Спрангер и др. (1994) су користили термин „колагенопатија типа 11“ да би описали наследне болести хрскавичног ткива са примарном мутацијом у гену проколагена типа II COL1A.
Класични облик Стиклеровог синдрома
Први пут га је описао 1965. године Г. Б. Стиклeр и колеге, назвавши га наследном артро-офталмопатијом. Синдром који је описао Г. Б. Стиклeр карактерисао је оштећење вида и тешка дегенеративна болест зглобова, која се обично развија у трећој или четвртој деценији живота. То је аутозомно доминантни поремећај са инциденцом од приближно 1 на 10.000 живорођене деце. Клиничка слика укључује миопију, прогресивну глувоћу, расцеп непца, хипоплазију мандибуле (Пјер-Робенова аномалија) и хипоплазију епифиза. У неонаталном периоду, рендгенски снимци пацијената са Стиклeровим синдромом откривају увећане епифизе, првенствено проксимални фемур и дисталну тибију. Током раста развија се епифизна дисплазија, која се манифестује неправилном осификацијом епифиза и накнадним дегенеративним променама.
Пошто се COL 2 A експресује у зглобној хрскавици и стакластом телу очне јабучице, појава Стиклеровог синдрома је повезана са патологијом овог гена. Међутим, испитивање неколико породица са Стиклеровим синдромом показало је да немају све породице болест повезану са COL 2 A. Овај облик болести се назива Стиклеров синдром типа I (симбол локуса STL1).
Спектар клиничких манифестација Стиклеровог синдрома значајно варира, а до данас је идентификовано неколико фенотипова. Међу њима је Вагнеров синдром, који карактерише претежно оштећење очне јабучице; остеоартрит код Вагнеровог синдрома се практично никада не развија, иако је код пацијената идентификована мутација гена COL 2 A (замена базе Gly67>Asp). Остаје нејасно зашто таква COL мутација угрожава само функцију стакластог тела и не утиче на хијалинску хрскавицу.
Други облик Стиклеровог синдрома је такозвана холандска варијанта; карактеришу је све класичне манифестације синдрома, осим оштећења вида. Х.Г. Брунер и др. (1994) су показали да је холандски фенотип Стиклеровог синдрома повезан са мутацијом у гену COL₂A2 : доминантна мутација је делеција од 54 базна пара праћена делецијом ексона. М. Сирко-Осадса и др. (1998) су известили о другој породици, која није повезана са оном коју су описали претходни аутори, са сличним фенотипом и мутацијом у гену COL₂A2 ( делеција од 27 базних парова), што потврђује податке Х.Г. Брунера и др. (1994). Ова варијанта се назива Стиклеров синдром типа II (симбол локуса STL1).
Недавно је идентификован трећи локус Стиклеровог синдрома код чланова породице са патологијом стакластог тела и мрежњаче који се фенотипски значајно разликују од промена примећених код „класичне“ варијанте синдрома. Код чланова ове породице пронађена је мутација у гену COL2A| (базна супституција Gly97>Val). Наравно, потребни су нови описи случајева овог фено- и генотипа Стиклеровог синдрома како би се потврдили налази А.Ј. Ричардса и сарадника.
Нозолошка веза између Маршаловог синдрома и класичне верзије Стиклеровог синдрома се дуго разматра. Сада се Маршалов синдром класификује као посебан фенотип углавном због израженије деформације фацијалног скелета, иако је оштећење периферних зглобова слично оном код Стиклеровог синдрома типа I. Код Маршаловог синдрома, остеоартритис колених зглобова и лумбосакралне кичме почиње након 30 година. Узрок синдрома је мутација у гену колагена типа IX COL n A1.
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ]
ОСМЕД
Овај фенотип је описан у холандској породици у којој су се дегенеративне промене у зглобовима које подсећају на остеоартрозу појавиле у адолесценцији и углавном су захватиле зглобове кука, колена, лакта и рамена; такође су пронађене необичне црте лица, повећана лумбална лордоза, увећани интерфалангеални зглобови и губитак слуха, али нису откривене визуелне аномалије (Vikkula M. et al., 1995). Истраживачи су пронашли мутацију у гену који кодира α2 -ланац колагена типа II COL,, A2.
Книста дисплазија
Карактерише га скраћивање трупа и удова, спљоштење лица и корена носа, егзофталмус и тешке абнормалности зглобова. Код пацијената са Книстовим синдромом, зглобови, обично велики од рођења, настављају да се увећавају у детињству и раној адолесценцији. Такође често имају миопију, губитак слуха, расцеп непца и клупско стопало; већина пацијената рано развија тешке дегенеративне промене, посебно изражене у зглобовима колена и кука. Рендгенски снимци кичме откривају спљоштеност и значајно издужење пршљенова и платиспондилозу. Дуге цевасте кости су деформисане попут тега, а осификација епифиза је спора. У зглобовима руку, епифизе су спљоштене, а зглобни простори сужени. Зглобна хрскавица је мекана, њена еластичност је смањена; хистолошки се у њој налазе велике цисте (симптом „швајцарског сира“). Книстов синдром је узрокован мутацијом у гену проколагена типа II COb2A1.
 [ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ]
[ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ]
Вишеструка епифизна дисплазија (МЕД)
Хетерогена група болести које карактерише абнормални развој плоча раста дугих цевастих костију, као и рана (манифестује се у детињству) тешка остеоартроза која погађа и аксијалне и периферне зглобове (најчешће зглобове колена, кука, рамена и шаке). Клинички, МЕД се манифестује као бол и укоченост у зглобовима, промене у ходању. Пацијенти са МЕД-ом такође имају минималне промене у кичменом стубу (различити степен спљоштености пршљенова), понекад је кичма нетакнута. Карактеристичан је и низак раст пацијената, мада се патуљасти раст ретко развија. Орган вида није погођен. МЕД укључује неколико варијанти, на пример, Фербанксов и Рибингов фенотип.
МЕД се наслеђују аутозомно доминантно са различитим степеном пенетрације. Пошто је обележје МЕД-ова аномалија епифизне плоче раста, сугерисано је да су ове дисплазије узроковане дефектом у генима који кодирају макромолекуле хрскавице плоче раста. Испоставило се да су најмање три локуса повезана са МЕД фенотипом. Студије Е.Ј. Вивера и др. (1993), Ј.Т. Хехта и др. (1992) искључиле су гене колагена типова II и VI, основног протеина протеогликана и везивног протеина хрскавице са листе „криваца“ за МЕД. Ј.Т. Хехт и др. (1993), Р. Оелман и др. (1994) пронашли су везу између МЕД-а, као и клинички повезаног синдрома псеудоахондроплазије, и перицентромерног региона хромозома 19. Накнадне студије су идентификовале мутацију у гену који кодира олигомерни матрични протеин хрскавице (ОММП) код три пацијента са МЕД-ом (симбол локуса ЕДМ1). Пошто су се све три мутације догодиле у региону гена који кодира домен OMMP-а који везује калцијум, вероватно је да је функција везивања калцијума овог протеина неопходна за нормалан развој хрскавице плоче раста.
М. Д. Бригс и др. (1994) су известили о холандској породици са MED фенотипом повезаним са регионом хромозома 1 који садржи један од гена колагена типа IX, COL1A1 (симбол локуса EDM 2). Приметно је да је пронађена мутација била први доказ улоге колагена типа IX, локализованог на површини фибрила колагена II, у одржавању интегритета хијалинске хрскавице. М. Дир и др. (1995) су показали да Фербанксов фенотип није генетски повезан ни са локусом EDM ни са локусом EDM2, што потврђује хетерогеност MED-а.
Метафизна хондродисплазија (МХД)
Хетерогена (описано је више од 150 типова) група наследних болести хијалинске хрскавице, које се клинички манифестују као рана остеоартроза. МХД карактеришу промене у коштаним метафизама. Клинички се манифестују као низак раст, скраћени удови, повијене потколенице и „патчји“ ход. Пацијенти са МХД такође показују знаке оштећења других система (на пример, имуног и дигестивног система). Уочава се дезорганизација хрскавице плоче раста, која се хистолошки манифестује као кластери пролиферисаних и хипертрофираних хондроцита окружених задебљаним септама и неорганизованим матриксом, као и продор некалцификоване хрскавице у субхондралну кост.
Јансенов, Шмидов и Маккузиков синдром су најпроученији МХД-ови. Слични су по карактеристикама скелетних аномалија, али се разликују по тежини (Јансенов синдром-Макузиков синдром-Шмидов синдром). Најчешћи је Шмидов синдром (симбол локуса МЦДС), који се наслеђује аутозомно доминантно. Радиолошки, синдром се манифестује кокса варом, скраћивањем и закривљеношћу цевастих костију, деформацијом метафиза у облику чашице (израженија у проксималном него у дисталном делу фемура). Најизраженије промене се примећују у плочама раста дугих цевастих костију.
Код пацијената са Шмидовим синдромом описано је најмање 17 различитих типова мутација гена колагена X. Колаген X се експресује у хипертрофираним хондроцитима плоча раста и може бити укључен у процесе осификације. Стога је мутација у гену колагена X COb2A1 највероватнији узрок Шмидовог синдрома.
Деца са Јансеновим синдромом имају хиперкалцемију, повишен ниво фосфата у урину и смањен ниво паратироидног хормона (ПТХ) и пептида повезаних са ПТ. Аномалија овог другог је вероватно одговорна за развој Јансеновог синдрома. Године 1994, А. С. Караплис и коаутори објавили су резултате оригиналне студије. Након поремећаја гена који кодира пептид повезан са ПТ у ембрионалним матичним ћелијама миша, мишеви са недостатком овог алела угинули су одмах након рођења. Утврђено је да имају аномалију у развоју субхондралне кости, оштећен раст хрскавице и смањену пролиферацију хондроцита. Године 1995, Е. Скипани и коаутори су известили о хетерозиготној мутацији у гену за ПТХ рецептор код пацијента са Јансеновим синдромом. Мутација се састојала од супституције базе Gys223>Arg, што је довело до акумулације цАМП; То значи да аминокиселина хистидин на позицији 223 игра кључну улогу у преносу сигнала. Касније су Е. Скипани и др. (1996) су пријавили још три пацијента са Јансеновим синдромом, од којих су два имала сличну мутацију, а трећи је имао TrА10>Рrо супституцију.
Примарни генерализовани остеоартритис
Најчешћи наследни облик остеоартритиса је примарни генерализовани остеоартритис (ПГОА), који су први пут описали као засебну нозологију ЈХ Келгрен и Р. Мур 1952. године. Клинички, примарни генерализовани остеоартритис карактерише појава Бушарових и Хеберденових чворова, полиартикуларних лезија. Примарни генерализовани остеоартритис карактерише раан почетак манифестације остеоартритиса и његова брза прогресија. Радиолошки, примарни генерализовани остеоартритис се не разликује од ненаследног остеоартритиса. Упркос чињеници да се питање етиопатогенезе примарног генерализованог остеоартритиса још увек расправља, студије показују важну улогу наследне предиспозиције у настанку и прогресији примарног генерализованог остеоартритиса.
Тако су ЈХ Келгрен и др. (1963) пронашли Бушареј-Хеберденове чворове код 36% мушких рођака и 49% женских рођака, док су у општој популацији ове бројке биле 17 и 26%, респективно. Код особа са примарним генерализованим остеоартритисом, чешће се детектују HLA A1B8 хаплотип и MZ изоформа α1-антитрипсина. У класичној студији која је укључивала близанце, Т.Д. Спектор и др. (1996) су извршили радиографију зглобова колена и зглобова шаке код 130 монозиготних и 120 двојајчаних женских близнакиња због промена карактеристичних за остеоартритис. Испоставило се да је подударност радиографских знакова остеоартритиса свих локализација била 2 пута већа код монозиготних близанаца у поређењу са двојајчаним близанцима, а допринос генетских фактора кретао се од 40 до 70%. Студија нодуларног остеоартритиса коју су спровели Г.Д. Рајт и др. (1997) показали су рани почетак болести, високу тежину тока и негативну корелацију између старости почетка болести код пацијената и старости зачећа њихових родитеља.
Међу артропатијама повезаним са кристалима, таложење кристала мокраћне киселине и кристала који садрже калцијум у зглобној шупљини има фамилијску предиспозицију.
Наследне артропатије повезане са кристалима (према Вилијамсу Ц.Ј. и Хименезу С.А., 1999)
Болест |
Локус |
Врста наслеђивања |
Мутирани ген |
Врста мутације |
Гихт (HPRT)* |
Xq27 |
X-повезано |
HPRT1 |
Супституција база, делеција |
Гихт (PRPS) |
Xq22-q24 |
X-повезано |
ПРПС1 |
Замена основе |
Примарна пирофосфатна артропатија (CCAL1) |
5р15.1-р15.2 |
ПАКАО |
? |
? |
Пирофосфатна артропатија раног почетка повезана са 0A (CCAL2) |
8q |
ПАКАО |
? |
? |
*Симболи локуса су дати у заградама; AD – аутозомно доминантан.
Године 1958, Д. Зинтан С. Ситај је представио клиничке описе патологије коју су назвали „хондрокалциноза“ код 27 пацијената. Већина пацијената је припадала пет породица, што указује на наследну компоненту у етиопатогенези болести. Касније су Д. Макарти и ЈЛ Холандер (1961) известили о два пацијента за које се сумњало да имају гихт са таложењем неуратних кристала у зглобној шупљини. Рендгенски преглед је открио абнормалну калцификацију хијалинске хрскавице многих зглобова.
Радиографски, болест таложења кристала калцијум пирофосфат дихидрата, или пирофосфатна артропатија, подсећа на спорадичну остеоартрозу, али чешће погађа зглобове који нису типични за уобичајене облике остеоартрозе (нпр. метакарпофалангеалне, скафорадијалне, пателофеморалне зглобове колена). Код пирофосфатне артропатије, чешће се формирају субхондралне коштане цисте. Иако се у већини случајева хондрокалциноза јавља пре манифестације секундарне остеоартрозе, код неких особа болест може почети као идиопатска остеоартроза, коју прате метаболички поремећаји (хемохроматоза, хиперпаратиреоидизам, хипомагнезијемија итд.).
Највероватније, структурне промене у ванцелуларном матриксу зглобне хрскавице индукују таложење кристала калцијум пирофосфат дихидрата. АО Бјеле (1972, 1981) је пронашао смањење садржаја колагена и фрагментацију колагенских влакана у средњој зони матрикса зглобне хрскавице чланова шведске породице са пирофосфатном артропатијом. Пошто ова подручја нису садржала кристале, аутори сугеришу да описана аномалија матрикса може предиспонирати њихово таложење и развој дегенеративних промена у зглобовима. На основу студије спорадичних случајева пирофосфатне артропатије, К. Ишикава и др. (1989), И. Масуда и др. (1991) закључили су да је хондрокалциноза узрокована мутацијом у генима који кодирају протеине ванцелуларног матрикса. ЦЈВилијамс и др. (1993), АЈ Реџинато и др. (1994) пронашли су хетерозиготну мутацију COL 2 A, (замена база Argl5>Cys) код чланова велике породице са клиничким фенотипом тешког раног остеоартритиса са анкилозом, касним развојем спондилоепифизне дисплазије и хондрокалцинозом хијалина и фиброхрскавице. Међутим, испоставило се да је код чланова ове породице хондрокалциноза била секундарна у односу на остеоартритис.
Такође је сугерисано да неорганске компоненте ванцелуларног матрикса доприносе стварању кристала. На пример, хипомагнезијемија изазива хондрокалцинозу инхибирањем ензима пирофосфатазе, што заузврат смањује растварање кристала. Повишени нивои неорганских фосфата пронађени су у синовијалној течности пацијената са пирофосфатном артропатијом. Ово и друга запажања сугеришу да пацијенти са пирофосфатном артропатијом имају локални поремећај метаболизма пирофосфата. Описан је ензим нуклеозид трифосфат пирофосфохидролаза, који може бити укључен у формирање кристала пирофосфата у подручју њиховог таложења у ванцелуларном матриксном матриксу. Повишени нивои овог ензима пронађени су у спорадичним случајевима пирофосфатне артропатије, али ова абнормалност није примећена код породичних облика болести (Ryan LM et al., 1986). Међутим, приликом култивације фибробласта и лимфобласта пацијената са породичном пирофосфатном артропатијом, откривено је повећање садржаја неорганских фосфата, што такође потврђује претпоставку о улози поремећаја у локалном метаболизму пирофосфата у патогенези болести.
Последњих година учињени су покушаји да се идентификују гени „криви“ за појаву породичних случајева пирофосфатне артропатије. Тако је анализа генетског материјала добијеног од чланова велике породице са пирофосфатном артропатијом (Мејн, САД), код које се хондрокалциноза развила секундарно у односу на тешку, брзо прогресивну, недиспластичну остеоартрозу, искључила везу између болести и локуса COL 2. Међутим, аутори ове студије пронашли су везу између проучаваног фенотипа пирофосфатне артропатије и локуса који се налази на дугом краку хромозома 8 (симбол локуса CCAL). А. Г. Хјуз и др. (1995) пронашли су везу између фенотипа примарне хондрокалцинозе у породици из Велике Британије и локуса CCAL1, који је локализован на кратком краку хромозома 5 у региону 5p15. Према Ц. Џ. Вилијамсу и др. (1996), локус CCAL1 код чланова аргентинске породице са пирофосфатном артропатијом био је лоциран нешто проксималније него у претходном случају, у региону 5p15.1. Сличан генотип је пронађен код чланова породице из Француске.
Дакле, подаци из описаних студија указују да је фамилијарни облик пирофосфатне артропатије клинички и генетски хетерогена болест, која може бити узрокована мутацијама у најмање три различита гена.

